Теоретические и технологические основы окислительного и сульфатизирующего обжига
Наибольшее распространение окислительный и сульфатизирующий обжиг получил в технологии переработки сульфидных руд, которые являются доминирующим сырьем для извлечения Сu, Nі, Со, Мо, Zn и Рb. Сульфиды тяжелых цветных металлов могут окисляться в зависимости от температуры по различным схемам: при низких температурах (например, в природных условиях) - до сульфатов, а при температурах обжига 970 - 1170 К - до оксидов. При высоких температурах окислениесульфида может привести к образованию металла. Образование оксидов и сульфатов при обжиге происходит по следующим конечным реакциям:
MeS+1,5O2=MeO+SO2; (12)
2SO2+O2=2SO3; (13)
MeO+SO3=MeSO4 (14)
Первая реакция практически необратима, для второй реакции константа равновесия равна  откуда:
откуда:
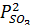 =
= 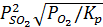 (15)
(15)
Для третьей реакции 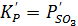
Когда парциальное давление сернистого ангидрида в печных газах Pso2 больше давления диссоциации сульфата 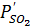 , т.е. когда
, т.е. когда
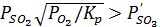 (16)
(16)
идет образование оксида (окислительный обжиг). Реакции окисления сульфидов до оксидов характеризуются значительной убыльюстандартного изобарно - изотермического потенциала и, следовательно, имеют большую вероятность реализации. Однако, полнота потенциала различных реакций этого типа будет неодинаковой. При данных температуре и составе газовой фазы более вероятен тот процесс, который отвечает большим концентрациям сернистого ангидрида в равновесной газовой смеси (SO2 + O2) , т.е. большей константе равновесия 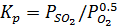 . Например, окисление сульфида железа должно идти преимущественно до Магнетита, затем до оксида и т.д. Аналогичные термодинамические закономерности лежат и в основе протекания реакций окисления сульфидов до сульфатов, в этом случае при одних и тех же режимах вероятнее осуществление процессах образованием сульфатов щелочных и щелочноземельных металлов и затем сульфатов» цветных металлов. Реакции окисления сульфидов сопровождаются образованием металла, при температурах обжига реализуются не для всех сульфидов. Константа равновесия реакций этого типа равна Кp=Pso2/Po2 . Например, константы равновесия сернистого ангидрида для реакции окисления сернистого Са кислородом ничтожно малы, т.е. термодинамически при этих температурах процесс окисления сернистого Caс образованием металла невозможен. Для остальных рассмотренных сульфидов образование металла термодинамически возможно, но полнота протекания процесса в каждом отдельном случае будет определяться величиной константы равновесия. Процесс окислительного обжига сульфидов с образованием оксидов металлов сопровождается выделением большого количества тепла. Поэтому после нагрева сульфидов; до температуры их воспламенения их окисление осуществляется самопроизвольно или автогенно, т.е. без подвода тепла извне. В связи с этим температура обжига должна быть выше температуры воспламенения сульфидов, которая при крупности зерен 0,06 мм в атмосфере воздуха равна. К: пирита (FеS2)633 халькопирита (СuFеS2)653, халькозина (Сu2S)708, галенита (РbS)1028, сфалерита (ZnS)888, антимонита (Sb2S3)598, миллерита (NiS)928, S элементарной 563. Было изучено воспламенение медных концентратов норильского; красноуральского и шихты из него, а также золотушинского. Определено, что температура начала воспламенения медных концентратов зависят от вида сырья и не зависят от концентрации кислорода в газовой смеси. Подшихтовка к норильскому концентрату до 16 % кремнезема незначительно влияет на температуру начала воспламенения. Температуры воспламенения концентратов равны. К: для норильского 561 - 566, красноуральского - 60Т, его шихты - 593 и золотушинского - 616. Опыты показали, что концентрация кислорода в дутье и содержание в шихте кремнезема в значительной степени определяют интенсивность протекания процесса воспламенения. Чем выше концентрация кислорода, тем интенсивнее осуществляется горение материала, что приводит к более сильному разогреву пробы. В случае гранулированного концентрата процесс воспламенения протекает в две стадии сравнительно спокойно, и затянут во времени. Температурные максимумы равны соответственно 890 и 910 К. Концентрация кислорода в дутье 20 %. С увеличением концентрации кислорода процесс горения идет более интенсивно, что влечет за собой более резкий разогрев материала пробы. Так, при содержании 68 % кислорода в дутье температура возрастает до 1113 К, а при 90 % - до 1208 К.В последнем случае отмечалось оплавление материала. Такая же закономерность, но с более низкими значениями температур отмечалась и для не гранулированных концентратов и шихт. Добавление к концентрату кремнезема (до 16 %) мало изменяет температуру начала воспламенения, но значительно влияет на характер протекания процесса. С увеличением добавок кремнезема заметно уменьшается интенсивность реакции: экзо эффекты на кривых нагревания становятся все более растянутыми, уменьшается температура их максимума вследствие увеличения теплопотребления материала пробы. Различие процесса воспламенения проб, в случае гранулированного и не гранулированного концентрата обусловлено различной степенью контакта частиц материала с газовой средой, подводом кислорода к реакционной поверхности и отводом продуктов реакции. Максимальные температуры воспламенения красноуральского концентрата и его шихты соответственно равны 873 и 868 К. Пики экзоэффектов растянуты, что указывает на замедленный характер протекания процесса горения продукта. Площадь пика для шихты красноуральского концентрата меньше, чем для чистого концентрата. Это объясняется значительным разубоживанием концентрата инертным материалом (оксидами, пылями и т.д.) с большим теплопотреблением. Воспламенение золотушинского концентрата отмечается при температуре 616 К.Температура в пробе скачком возрастает до 1028 К и затем резко падает до 830 К.На практике температура обжига для воспламенения сульфидов обычней колеблется от 853 до 1123 К - и не должна превышать 1173 К, так как при более высокой температуре начинается плавление отдельных сульфидов, образование легкоплавких эвтектик и спекание частиц материала, препятствующих нормальному течению процесса обжига. Температура плавления некоторых сульфидов, по данным, составляет, К: FеS - 1444, Cu2S - 1408, РbS - 1393, ZnS - 1943, Ag2S - 1085,CoS - 1413, Ni3S2 - 1057, Sb2S3 - 819, SnS – 1153, Na2S - 1193, MnS - 1803,CaS - 2173. Кроме температур плавления Отдельных сульфидов, необходимо также учитывать возможность образования при обжиге их эвтектик, которые плавятся обычно при более низких температурах:
. Например, окисление сульфида железа должно идти преимущественно до Магнетита, затем до оксида и т.д. Аналогичные термодинамические закономерности лежат и в основе протекания реакций окисления сульфидов до сульфатов, в этом случае при одних и тех же режимах вероятнее осуществление процессах образованием сульфатов щелочных и щелочноземельных металлов и затем сульфатов» цветных металлов. Реакции окисления сульфидов сопровождаются образованием металла, при температурах обжига реализуются не для всех сульфидов. Константа равновесия реакций этого типа равна Кp=Pso2/Po2 . Например, константы равновесия сернистого ангидрида для реакции окисления сернистого Са кислородом ничтожно малы, т.е. термодинамически при этих температурах процесс окисления сернистого Caс образованием металла невозможен. Для остальных рассмотренных сульфидов образование металла термодинамически возможно, но полнота протекания процесса в каждом отдельном случае будет определяться величиной константы равновесия. Процесс окислительного обжига сульфидов с образованием оксидов металлов сопровождается выделением большого количества тепла. Поэтому после нагрева сульфидов; до температуры их воспламенения их окисление осуществляется самопроизвольно или автогенно, т.е. без подвода тепла извне. В связи с этим температура обжига должна быть выше температуры воспламенения сульфидов, которая при крупности зерен 0,06 мм в атмосфере воздуха равна. К: пирита (FеS2)633 халькопирита (СuFеS2)653, халькозина (Сu2S)708, галенита (РbS)1028, сфалерита (ZnS)888, антимонита (Sb2S3)598, миллерита (NiS)928, S элементарной 563. Было изучено воспламенение медных концентратов норильского; красноуральского и шихты из него, а также золотушинского. Определено, что температура начала воспламенения медных концентратов зависят от вида сырья и не зависят от концентрации кислорода в газовой смеси. Подшихтовка к норильскому концентрату до 16 % кремнезема незначительно влияет на температуру начала воспламенения. Температуры воспламенения концентратов равны. К: для норильского 561 - 566, красноуральского - 60Т, его шихты - 593 и золотушинского - 616. Опыты показали, что концентрация кислорода в дутье и содержание в шихте кремнезема в значительной степени определяют интенсивность протекания процесса воспламенения. Чем выше концентрация кислорода, тем интенсивнее осуществляется горение материала, что приводит к более сильному разогреву пробы. В случае гранулированного концентрата процесс воспламенения протекает в две стадии сравнительно спокойно, и затянут во времени. Температурные максимумы равны соответственно 890 и 910 К. Концентрация кислорода в дутье 20 %. С увеличением концентрации кислорода процесс горения идет более интенсивно, что влечет за собой более резкий разогрев материала пробы. Так, при содержании 68 % кислорода в дутье температура возрастает до 1113 К, а при 90 % - до 1208 К.В последнем случае отмечалось оплавление материала. Такая же закономерность, но с более низкими значениями температур отмечалась и для не гранулированных концентратов и шихт. Добавление к концентрату кремнезема (до 16 %) мало изменяет температуру начала воспламенения, но значительно влияет на характер протекания процесса. С увеличением добавок кремнезема заметно уменьшается интенсивность реакции: экзо эффекты на кривых нагревания становятся все более растянутыми, уменьшается температура их максимума вследствие увеличения теплопотребления материала пробы. Различие процесса воспламенения проб, в случае гранулированного и не гранулированного концентрата обусловлено различной степенью контакта частиц материала с газовой средой, подводом кислорода к реакционной поверхности и отводом продуктов реакции. Максимальные температуры воспламенения красноуральского концентрата и его шихты соответственно равны 873 и 868 К. Пики экзоэффектов растянуты, что указывает на замедленный характер протекания процесса горения продукта. Площадь пика для шихты красноуральского концентрата меньше, чем для чистого концентрата. Это объясняется значительным разубоживанием концентрата инертным материалом (оксидами, пылями и т.д.) с большим теплопотреблением. Воспламенение золотушинского концентрата отмечается при температуре 616 К.Температура в пробе скачком возрастает до 1028 К и затем резко падает до 830 К.На практике температура обжига для воспламенения сульфидов обычней колеблется от 853 до 1123 К - и не должна превышать 1173 К, так как при более высокой температуре начинается плавление отдельных сульфидов, образование легкоплавких эвтектик и спекание частиц материала, препятствующих нормальному течению процесса обжига. Температура плавления некоторых сульфидов, по данным, составляет, К: FеS - 1444, Cu2S - 1408, РbS - 1393, ZnS - 1943, Ag2S - 1085,CoS - 1413, Ni3S2 - 1057, Sb2S3 - 819, SnS – 1153, Na2S - 1193, MnS - 1803,CaS - 2173. Кроме температур плавления Отдельных сульфидов, необходимо также учитывать возможность образования при обжиге их эвтектик, которые плавятся обычно при более низких температурах:
| Компоненты | Состав эвтетики, % | Т, К |
| FeS-Fe | 85FeS | |
| FeS-Cu2S | 32,4 Cu2S | |
| FeS-ZnS | 5ZnS | |
| FeS-PbS | 30FeS | |
| FeS-Ag2S | 11FeS | |
| Cu2S-Cu | 3,8Cu2S | |
| Cu2S- Ag2S | 30 Cu2S | |
| Cu2S-PbS | 51 Cu2S | |
| Cu2S-Ni3S2 | 23 Cu2S | |
| Cu2S-Na2S | 50 Cu2S | |
| Cu2S-Na2S | 78 Cu2S | |
| Ni-Ni3S2 | 21,5 S |
Температура воспламенения сульфида является такой, при достижении которой окисление идет настолько интенсивно, что выделяющегося при этом тепла достаточно для самопроизвольного распространения процесса по всей массе материала. Температура воспламенения зависит как от физических и химических свойств сульфидов, так и от внешних условий. Из физических свойств следует отметить теплоемкость, теплопроводность и плотность сульфида и продуктов его окисления. Чем выше теплоемкость и плотность их, тем выше температура воспламенения. Из химических свойств имеет значение структура сульфида и тепловой эффект реакции его окисления. При высоком тепловом эффекте уже небольшое количество вступающего в реакцию вещества вызывает повышение температуры и повышение скорости реакции окисления. Внешними условиями,, влияющими на температуру воспламенения сульфида, являются характеристика среды, в которой происходит окисление, наличие в шихте катализаторов и подавителей, ускоряющих или замедляющих процесс обжига и др. Окислительный обжиг может протекать в атмосфере воздуха (холодного или подогретого, обогащенного или обедненного кислородом), в струе чистого кислорода, в атмосфере углекислого газа или водяного пара, в атмосфере продуктов горения топлива. Эти и другие факторы оказывают влияние на температуру воспламенения и интенсивность окисления сульфидов. Основными условиями протекания сульфатизирующего обжига, в отличие от окислительного, являются: 1) пониженная температура, так как с повышением температуры возрастает вероятность диссоциации сульфатов; 2) повышенная концентрация серного или сернистого ангидрида в печных газах; 3) более длительное пребывание обжигаемого материала в зоне обжига в условиях интенсивного контакта с печными газами, что обусловлено менее интенсивным протеканием процесса сульфатизации (главным образом, за счет более низкой температуры процесса).Окислительный обжиг не сульфидных материалов имеет место в таких процессах, которые сопровождаются переходом металлов в оксиды или низших оксидов в высшие. Этот процесс является обратным диссоциации оксидов, их объединяют и общие физико - химические и молекулярно - кинетические закономерности.
Кинетика обжига складывается из скорости реакции окисления на поверхности сульфидов и из скорости процесса диффузии, т. е. скорости подвода реагирующих веществ к границе раздела фаз и скорости отвода от нее продуктов взаимодействия. Реакции обжига, несомненно, связаны с катализом, причем катализатором является один из продуктов окисления, другими словами, реакции обжига должны быть отнесены к автокаталитическим реакциям. Самый распространенный тип гетерогенного катализа — это катализ взаимодействия газа с твердыми поверхностями, т. е. катализ, связанный с адсорбцией, при этом реакции в адсорбированном слое идут быстрее, чем в объеме газа. Из продуктов окисления сульфидов каталитическое действие. На окисление сернистого ангидрида в серный оказывают оксид железа, оксид меди, закись никеля и другие оксиды металлов. Из химической кинетики известно, что гомогенные химические реакции, связанные с большой энергией активации, с повышением температуры ускоряются примерно на 10%, на каждый градус повышения температуры. Диффузионные процессы, связанные с уменьшенной энергией активации ускоряются с повышением температуры только на 1 —3 % на каждый градус подогрева. При низких температурах диффузионные процессы идут быстрее химических реакций. Но так как скорость химических реакций с повышением температуры нарастает быстрее, то при достижении определенного температурного предела эта скорость превышает
скорость диффузионных процессов и обжиг переходит из кинетической в диффузионную область.
Переход из кинетической в диффузионную область сопровождается воспламенением сульфидов. Простирание кинетической области зависит от величины зерен обжигаемого материала, состава печных газов, интенсивность нагрева и некоторых других факторов. Чем крупнее частицы, чем толще слой обжигаемого материала, тем больше значение при обжиге имеют явления диффузии.
Известны три вида диффузии: 1) обмен мест в узлах кристаллической решетки, 2) перемещение по междоузлиям и 3) эстафетное перемещение дырок.
По характеру процессов различают реакционную и пере- кристаллизационную диффузию.
При обжиге сульфидных материалов, несомненно, имеет место реакционная диффузия.
Наиболее типичным примером реакционной диффузии при обжиге сульфидных материалов может служить обжиг кусковых руд на так называемое «ядро». Этот вид обжига в старину применялся как своеобразный метод обогащения сульфидных руд. В литературе приводится ряд интересных примеров обжига «на ядро». При этом виде обжига медь концентрируется в ядре каждого куска, а наружная оболочка каждого куска состоит преимущественно из оксидов железа. Так, в одном случае исходная руда имела следующий состав: 1,6% меди, 43,5% железа, 50,15% серы, 5,0% —кремнезема. При обжиге, в каждом куске руды было получено ядро следующего состава, 41,64% меди, 28,76% железа, 29,28 % — серы, 0,08% кремнезема. Ближайшая к ядру оболочка имела состав, 3,31% меди, 85,7% оксида железа, 2,85% кремнезема и 0,92% серы.
Обжиг на ядро применялся на закавказских медеплавильных заводах, в частности на Кедабегском заводе. Было известно, что обжиг на ядро получается при рудах в кусках размерами около 100 мм в том случае, когда руда при обжиге не декриптирует.
Для объяснения явления концентрации меди в центре куска раньше был, выдвинут ряд различных гипотез. Например, было, сделано предположение, что причиной концентрации меди в ядре является образование при обжиге легкоплавких эвтектик из сульфидов железа и меди. Другая гипотеза, выдвинутая Фридрихом на основании исследований Шенка и Гемпельмана, изучавших систему медь — сера — кислород, объясняет появление обогащенного медью ядра образованием эвтектики полусернистой меди и сульфата меди.
Все эти предположения не объясняют явления, в частности того, что богатые медью сульфиды концентрируются в центре, каждого куска, а не стекают вниз к основанию рудного отвала, в котором осуществляется кучной обжиг «на ядро». Совершенно очевидно, что истинной причиной концентрации меди в центре кусков является двухсторонняя диффузия серы и железа на поверхность кусков и кислорода в обратном направлении.
Было установлено, что при окислении сернистой меди при темперагурах 473 — 673 К гексагональная решетка сульфида перестрливается в моноклиническую кристаллическую решетку оксида меди обогащением по меди и объемным изменением (увеличением плотности).
Подобная перестройка происходит чисто диффузионным путем, а именно за счет встречной диффузии серы и кислорода. При этом кислород замещает серу, а сера, продиффундировав на наружную границу раздела твердой и газообразной фаз, взаимодействует с кислородом и образует сернистый ангидрид, который переходит в окружающую газовую среду.
При температуре 873 К окисление сульфида меди протекает очень интенсивно наружный слой сульфида переходит в оксид, а внутренний - в закись меди. Выделение сернистого ангидрида сказывается на прочности вязи оксида и закиси меди. Эти слои связаны очень слабо и легко отделяются один от другого. В то всё же время кристаллы одного и того же слоя связаны между собою достаточно прочно.
Рентгеноструктурные исследования диффузионных явлений в системе медь- сера, проведенные теми же авторами, показали, что при температуре 423-473 К идет медленная двухсторонняя, диффузия, а при температуре 573- 673 К образуется два слоя — внутренний из полусернистой меди и наружний — из сернистой меди. Рост продуктов реакции наблюдается вглубь металла и на его наружной поверхности, при этом перемещение меди получается более быстрое, чем перемещение в противоположном направлении серы (быстрый рост сульфида во внешнюю сторону). Между слоями сернистой и полусернистой меди контакт сохраняется только в отдельных точках, которые являются своеобразными мостиками, через которые проходят диффундирующие атомы или ионы. Пористость внутреннего слоя полусернистой меди, подобная вюститу, обусловливает его дырчатую структуру и обеспечивает переход ионов меди на наружную Поверхность сульфида.
Сера, по-видимому, перемещается не в виде ионов, а в виде атомов. Ее атомный радиус 1,06 А, а радиус иона двухвалентной серы 1,82 А. Медь перемещается, вероятно (в виде ионов, радиус которых 0,8 А. Перемещение меди в виде атомов с радиусом 1,28 А потребовало бы большой энергии разрыхления. При окислительном обжиге сульфидных материалов несомненно идет двухсторонняя диффузия с перемещением атомов серы на наружную поверхность и встречным движением атомов (или ионов) кислорода.
При обжиге крупнокусковых руд происходит также диффузия на поверхность отдельных кусков ионов железа, так как только этим можно объяснить обогащение поверхностного слоя и соответствующее обеднение центрального ядра железом.
Как отмечалось, обжиг «на ядро» имеет место при величине кусков порядка 100 мм в поперечнике и при не декриптирующих рудах. При мелкокусковых материалах явление концентрации меди в центрах кусков не наблюдается. Отсюда следует, что диффузионные процессы с уменьшением размеров кусков обжигаемого сульфидного материала проявляются в меньшей степени даже при подовом обжиге мелких материалов, когда эти материалы образуют слой толщиной до 200 — 300 мм и больше, явления диффузии при обжиге имеют очень большое значение и в большинстве случаев определяют скорость процесса.
По мере утолщения поверхностной пленки продуктов окисления сульфида скорость реакции при одной и той же температуре течением времени замедляется и реакция окисления тормозится связи с этим скорость реакции окисления сульфида не подчиняется обычным уравнениям для реакций первого порядка и зависит от коэффициента торможения, который характеризует сопротивление поверхностной пленки диффузии.
Скорость диффузии кислорода и других участников взаимодействия зависит от плотности поверхностной плёнки. Экспериментально установлено, что при образовании на поверхности сульфидов железа оксида (гематита) процесс обжига протекает быстрее, чем в случае образования пленки магнетита объясняется это тем, что магнетит значительно плотнее гематита.
В современных видах обжига сульфидных материалов во взвешенном состоянии и в кипящем слое, когда мелкие частицы материала находятся в разобщенном состоянии и имеют большую поверхность соприкосновения с кислородом печных газов диффузионные процессы оказывают меньшее влияние на кинетику обжига в сравнении со старыми видами обжига. Но при обжиге цинковых концентратов с повышенным содержанием примесей роль диффузионных процессов значительно возрастает.
Дата добавления: 2017-06-13; просмотров: 2626;











