Теоретические основы диссоциации карбоната кальция
К теоретическим основам процесса относятся термодинамические и молекулярно - кинетические закономерности. Термодинамический анализ позволяет предсказать направление течения процесса и конечный состав реагирующих веществ в равновесном (стандартном) их состоянии.
Программным модулем Equilibrium Compositions комплекса HSC-5.1 Chemistry (по ΔG0T =0) определено, что начало диссоциации СаСО3 по уравнению СаСО3=СаО+СО2 составляет 886,1 0С (таблица 1).
Таблица 1 -Влияние температуры на ΔG0T разложения СаСО3
| Т, 0С | 886,1 | ||||||||
| ΔG0T, ккал/моль | 9,96 | 6,44 | 2,96 | -0,47 | -3,86 | -7,2 | -10,51 | -12,14 | 0,0 |
Диссоциация СаСО3 - эндотермический процесс. С повышением температуры тепловой эндотермический эффект уменьшается (таблица 2).
Таблица 2- Влияние температуры на ΔН0T разложения СаСО3
| Т, 0С | ||||||
| ΔН0T, ккал/моль | 35,5 | 34,5 | 34,1 | 33,2 | 32,8 | 32,3 |
Более детальный анализ программным модулем Equilibrium Compositions (рисунок 3), показывает, что заметная (>1%) степень диссоциации СаСО3 отмечается при Т≥600 ºС, а практически полная (99,6%)- при 1300 0С.
Рисунок 3. Влияние температуры на равновесное количество веществ (кг) при разложении 1 кмоль СаСО3 (100 кг)
Разложение СаСО3- типичный эендотермический процесс типа Т1=Т2+Г. Графическая зависимость прореагировавшей доли вещества от времени для таких реакций имеет характерный сигмоидный вид. На кривой (рисунок 4) можно выделить участки, соответствующие следующим стадиям:
1. образованию зародышей (ядер) в различных местах кристалла, или индукционный период;
2. периоду акселерации, когда эти зародыши (ядра) растут;
3. периоду спада, когда зародыши частично перекрываются и площадь поверхности раздела фаз между реагирующим веществом и продуктом реакции уменьшается (часть кривой за точкой перегиба) (рисунок 5).
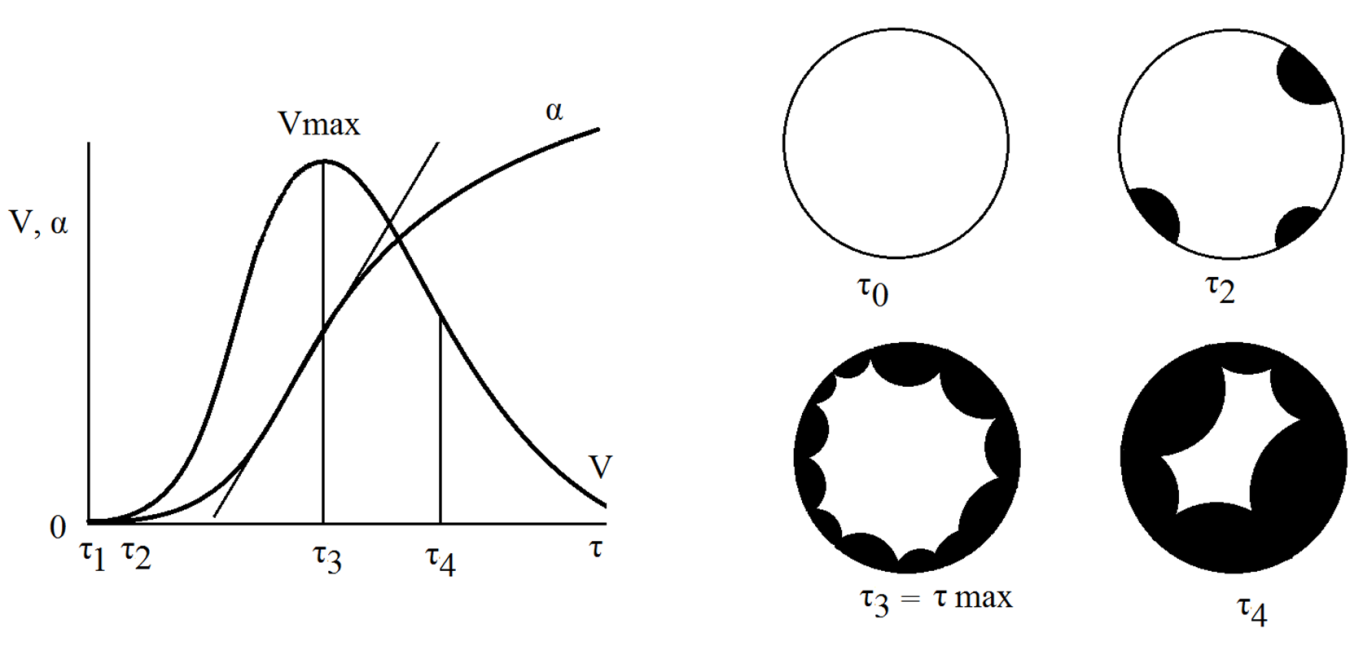
| α- степень протекания процесса; V- скорость Рисунок 4. Типичные кинетические τ1=0 исходные состояние, τ2 -возникновение отдельных ядер фазы продукты реакции, τ3 - рост ядер продукта вплоть до их смыкания с образованием сплошного слоя продукта; τ4- рост сплошного слоя | Рисунок 5 . Схема развития реакционной зоны на зернах порошка |
Влияние температуры на степень декарбонизации СаСО3 приведено на рисунке 6, из которого видно, что практически полное разложение отмечается при температуре 1100 0С в течение 120 минут.
Критерий Пиллинга-Бедвордса для разложения СаСО3 составляет:
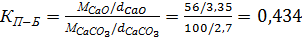 (1)
(1)
Поэтому слой СаО на поверхности СаСО3 - рыхлый и процесс не сдерживается диффузией реагентов. Декарбонизация СаСО3 описывается уравнением :
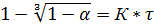 (2)
(2)
где 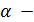 степень декарбонизации, доли 1;
степень декарбонизации, доли 1; 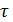 - время, мин; К- константа скорости.
- время, мин; К- константа скорости.
Кажущаяся энергия активации декарбонизации СаСО3 при 950 0С составляет 164 кДж/моль, а при 1200 0С-82 кДж/моль. То есть процесс протекает в кинетическом режиме и лимитируется образованием кристаллических зародышей СаО.
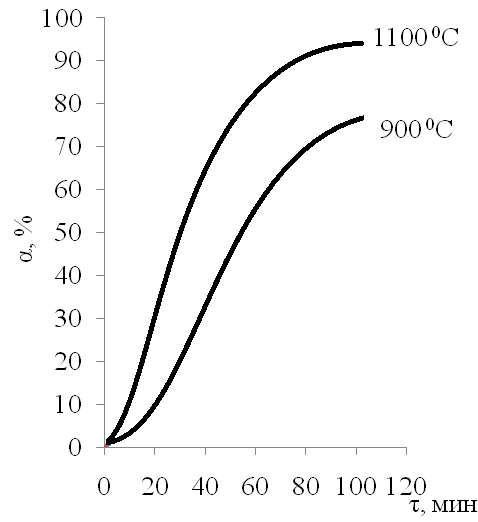
Рисунок 6. Влияние температуры и времени на степень разложения СаСО3 фракции 3-5 мм
Время полного разложения СаСО3 рассчитывается по формуле:
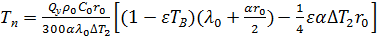 , (3)
, (3)
где 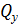 -удельный расход тепла, к Дж/моль;
-удельный расход тепла, к Дж/моль; 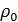 - плотность частицы, кг/м3;
- плотность частицы, кг/м3; 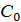 - начальная концентрация вещества, %;
- начальная концентрация вещества, %; 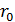 -радиус частицы, м,
-радиус частицы, м, 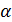 -степень разложения, %;
-степень разложения, %; 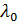 -коэффициент теплопроводности,
-коэффициент теплопроводности, 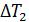 - разность температур среды и вещества, 0С;
- разность температур среды и вещества, 0С; 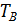 - температура разложения, 0С.
- температура разложения, 0С.
Процесс диссоциации состоит из следующих стадий:
а) разрушение частиц СаСО3 с образованием пересыщенного раствора СаО в СаСО3;
б) распад пересыщенного раствора с образованием кристаллов;
в) десорбция и последующая диффузия газа.
Разрушение частиц СаСО3 при нагревании сводится к отрыву иона О2- от аниона СО-23. Для осуществления этого процесса частицы должны накопить известный запас кинетической энергии, необходимой дня разрушения старых связей и образования новых.
При протекании топохимических процессов помимо распада аниона весьма существенную роль играет стадия разрушения кристаллической решетки.
Согласно кинетической теории процесса зарождения новой фазы в любой молекулярной или атомной системе, находящейся в состоянии теплового равновесия, в различных ее точках происходят отклонения различных параметров от наиболее вероятных значений. Эти отклонения непрерывно возникают и исчезают; они могут изменяться в широких пределах.
Начиная с некоторой величины, называемой критической, отклонения становятся более устойчивыми и не исчезают со временем, а продолжают расти, в результате чего образуются центры кристаллизации новой фазы. В зависимости от заданных условий изменяется уровень критических отклонений. Возникновение последних сопровождается изменением «свободной энергии» системы не только вследствие различия химических потенциалов частиц в новом µ2 и старом µ1, состояниях, но также и за счет образования поверхности раздела s.
Наиболее благоприятные условия для распада создаются там, где имеются наибольшие искажения решетки и связь между частицами сильно ослаблена, а запас свободной энергии достаточно высок. Такие места являются активными центрами, где начинается и осуществляется распад анионов.
По мере развития процесса распада СО2-3 вблизи активных центров происходит накопление адсорбированных молекул СО2, и увеличение концентрации ионов О2- в поверхностном слое, следствием чего является искажение этого участка кристаллической решетки и образование пересыщенного раствора СаО в СаСО3, так как растворимость первого в последнем невелика.
Десорбция СО2 происходит относительно легко и быстро. При достаточно больших концентрациях О2- в поверхностном слое активных участков могут возникать кристаллические зародыши. Образующаяся новая фаза будет высокодисперсной, следовательно, она будет обладать повышенным запасом свободной энергии. Последнее обстоятельство делает ее метастабильной, что обусловливает появление ложных равновесий.
С уменьшением числа дефектных мест у исходных кристаллов СаСО3, а также с уменьшением отклонения системы от равновесия (малые пересыщения) снижается и число возникающих зародышей в единицу времени. Следовательно, чем крупнее кристаллы исходного СаСО3 и чем правильнее они огранены, тем медленнее совершается переход активных центров исходной фазы в зародыши новой, т. е. тем длительнее так называемый индукционный период, во время которого может наблюдаться перегрев реакционной зоны.
Наглядной иллюстрацией к описанной схеме механизма процесса диссоциации является перегрев СаСО3 в начальный период разложения крупнокристаллических образцов. Температура начала заметного разложения этих образцов была на 6—7 °С выше температуры ядра куска в основном периоде диссоциации. Крупнокристаллические образцы СаСО3 имели меньше активных центров, что затрудняло образование кристаллических зародышей СаО. Повышение температуры ускоряет все стадии процесса, в частности разрушение кристаллической решетки и диффузионное перемещение ионов, необходимые для возникновения и роста кристаллов новой фазы. С момента образования кристаллических зародышей процесс развивается на границе раздела СаО—СаСО3. Образующаяся СаО оказывает деформирующее действие на анион СО2-3 облегчая его распад. Температура реакционной зоны при этом понижается.
Если число кристаллических зародышей велико, то для их роста количество новой фазы может оказаться недостаточным и кристаллы будут мелкими. В том случае, когда зародышей мало, образующееся вещество расходуется в основном на рост кристаллов, и продукт получается крупнокристаллическим.
На конечный размер кристаллов продукта влияет соотношение скоростей образования зародышей и роста кристаллов. Если скорость кристаллизации (скорость роста кристаллов) выше скорости зарождения зародышей, то продукт будет крупнокристаллическим, и наоборот
Появление границы раздела фаз СаО — СаСО3 действует как ускоряющий фактор, и процесс диссоциации приобретает автокаталитический характер. После того как отдельные участки поверхности раздела, образующиеся вокруг активных центров, сольются, по мере продвижения реакции вглубь кристалла СаСО3 поверхность раздела будет уменьшаться. Последнее обстоятельство вызовет понижение скорости процесса.
Дата добавления: 2017-06-13; просмотров: 4144;











