Лекция 4 на тему: Ацетиленовые углеводороды (алкины). Арены.
Алкины – углеводороды ациклического ряда, содержащие в своей структуре два атома углерода, связанные между собой тремя связями, а оставшиеся валентности этих атомов могут быть затрачены на образование связей с другими атомами углерода или атомами водорода.
Алкины образуют гомологический ряд соединений, выраженных общей формулой СnH2n-2. Первый член гомологического ряда – этин или ацетилен.
Изомерия и номенклатура
Согласно IUPAC названия алкинов образуют, заменяя в названиях алканов суффикс “-ан” на “-ин”. В качестве родоначальной структуры выбирают самую длинную цепь, содержащую тройную связь. Нумерацию этой цепи начинают с того конца, к которому ближе находится тройная связь.
Примеры
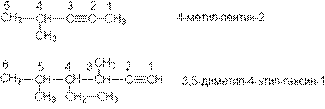
Названия остатков алкинов образуют, присоединяя суффикс –ил к названию алкина:
HC C- этинил
СН3-С С- пропинил-1
НС С-СН2- пропинил-2.
В рациональной номенклатуре замещенные алкины рассматриваются как производные ацетилена:
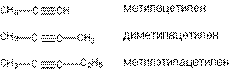
Структурная изомерия начинается с 4-го “С”, изомерия, связанная с изомерией углеродного скелета начиная с 5 “С”. По числу изомеров ацетиленовые углеводороды занимают промежуточное положение между алканами и алкенами.
Методы синтеза алкинов
4. Реакции пиролиза метана или этана
2CH4  C2H2 + 3H2
C2H2 + 3H2
CH3 - CH3  C2H2 + 2H2
C2H2 + 2H2
При пиролизе метана необходимо строго выдерживать время реакции. Для этого используется “закалка” - быстрый ввод на выходе реакционной зоны воды.
1. Карбидный метод
CaC2 + 2H2O C2H2 + Ca(OH)2 Аналогично реагируют карбиды стронция и бария SrC2, BaC2. Карбид магния с водой образует пропин
Mg2C3 +4 H2O CH3C CH + 2Mg(OH)2
2. Реакции нуклеофильного отщепления дигалогеналканов и моногалогеналкенов.
CH3-CHBr-CH2Br + 2NaOH 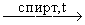 CH3-C CH + 2NaBr + 2H2O
CH3-C CH + 2NaBr + 2H2O
CH3-BrC=CH2 + NaOH 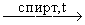 CH3-C CH + NaBr + H2O
CH3-C CH + NaBr + H2O
3. Алкилирование алкинов.
Реакции проводятся через синтез ацетиленидов
а) R-C CH + NaNH2 R-C C-Na+ + NH3
R-C CNa + R'Hal RC CR' + NaHal
б) R-C C-H +CH3-MgHal R-C C-MgHal + CH4
R-C C-MgHal + R’Hal R-C C-R’ + MgHal2
Физические свойства алкинов и природа связей
Алкины представляют собой бесцветные газы или жидкости. Начиная с С17 , алкины являются кристаллическими веществами.
Тройная связь представляет собой одну -связь С-С и две -связи. При переходе от двойной к тройной связи средняя энергия -связи снижается. Это означает, что тройная связь менее стабильна, чем двойная. Сам ацетилен неустойчивое соединение и способен к спонтанному взрывному распаду на элементы. Молекула ацетилена имеет линейное строение, что обусловлено sp-состоянием атомов углерода. Тройная связь в алкинах характеризуется более высокой поляризуемостью, чем в алкенах RC C = 5,96; RC=C=4,17.
Химические свойства алкинов.
Высокая степень ненасыщенности алкинов обусловливает их склонность к реакциям присоединения. В реакциях электрофильного присоединения алкины менее реакционноспособны по сравнению с алкенами, несмотря на то что энергия -связей у последних выше. Это обусловлено более высокой электрофильностью алкенов. В то же время в реакциях, имеющих гомолитический характер, например, каталитическое гидрирование, большую реакционную способность обнаруживают алкены.
1. Реакция гидрирования.
Реакция имеет ступенчатый характер:
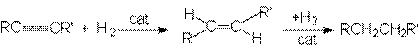
Сat: металлические Ni, Pl, Pd.
Реакции электрофильного присоединения.
2. Присоединение галогенов (Cl2 и Br2)
Алкины, подобно алкенам, участвуют в реакциях присоединительного галогенирования. Отличие состоит лишь в том, что алкин можен присоединить две молекулы галогена, а алкен – только одну:
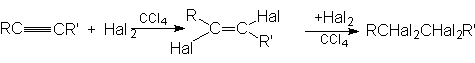
Промежуточный дигалогенид может быть получен присоединением одной молекулы галогена к алкину при низких температурах, причем реакция протекает преимущественно как транс-присоединение.
Реакции присоединения галогенов к алкинам как и другие реакции электрофильного присоединения, происходят медленнее, чем реакции присоединения к алкенам.
HC C-CH2-CH=CH2 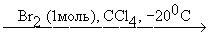 HC C-CH2-CHBr-CH2Br (90%)
HC C-CH2-CHBr-CH2Br (90%)
Такое соотношение реакционных способностей связано с различием устойчивости карбкатионов, образующихся при присоединении электрофильного реагента к кратным связям
2. Присоединение галогеноводородов к алкинам.
Присоединение хлоро- и бромоводорода к алкинам протекает также, как и к алкенам. Реакция имеет ступенчатый характер.
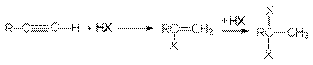
Обе реакции идут по правилу Марковникова.
а) альдольная конденсация
CH3CHO+CH3CHO  CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO 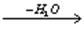 CH3CH=CH-CHO
CH3CH=CH-CHO  альдегидные смолы
альдегидные смолы
б) окисление
СH3CHO + 2Hg2+ 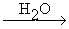 2Hg+ + CH3COOH + 2H+
2Hg+ + CH3COOH + 2H+
CH3CHO + Hg+ 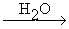 Hg + CH3COOH + 2H+
Hg + CH3COOH + 2H+
Подавление приведенных побочных реакций можно обеспечить путем увеличения скорости подачи ацетилена в реакционную зону. Благодаря этому образующийся альдегид отдувается из реакционной массы и степень его вовлечения в побочные реакции резко снижается.
4. Присоединение HCN.
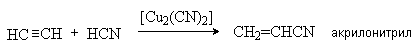
5. Присоединение спиртов.
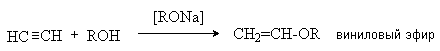
Изомеризация алкинов
Алкины способны к изомеризации с перемещением кратной связи или с превращением в диеновые углеводороды.
Под действие щелочных металлов тройная связь переходит на конец молекулы полученного ацетиленида. Действие спиртовых щелочей способствует переходу тройной связи с конца молекулы в центр. Промежуточными продуктами в этих превращениях являются алленовые углеводороды (Фаворский)
CH3CH2CCH 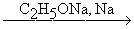 CH3CCCH3
CH3CCCH3
Окисление
RC CR' + KMnO4  RCOOH + R'COOH
RCOOH + R'COOH
RCCH 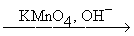 RCOOH + CO2
RCOOH + CO2
RCCR' 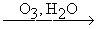 RCOOH + R'COOH
RCOOH + R'COOH
Окислительная конденсация терминальных алкинов.
2RCCH 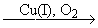 RCC-CCR
RCC-CCR
Полимеризация
1) Реакция Зелинского:
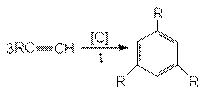
2) Димеризация:
2HCCH 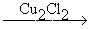 HCC-CH=CH2
HCC-CH=CH2 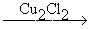 H2C=CH-CC-CH=CH2
H2C=CH-CC-CH=CH2
винилацетилен дивинилацетилен
Карбонилирование (Реппе)
CHCH + CO + H2O CH2=CH-COOH акриловая кислота
CHCH + CO + ROH CH2=CH-COOR эфир акриловой кислоты
CHCH + CO + NH3 CH2=CH-CONH2 амид акриловой кислоты
Катализаторами этих реакций являются карбонилы никеля и кобальта.
Дата добавления: 2017-04-05; просмотров: 2608;











