Изомерия и номенклатура одноатомных алканолов
В зависимости от типа углеродного атома, с которым связана гидроксильная группа, различают первичные, вторичные и третичные алканолы (спирты):

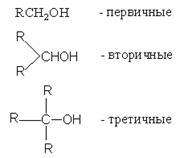
Согласно заместительной номенклатуре, углеродные атомы цепи нумеруют таким образом, чтобы гидроксильная группа обозначалась меньшим номером. Если гидроксильная группа старшая, то ее обозначают суффиксом “-ол”. Если в молекуле имеются более старшие группы ( С = О, СООН), то гидроксильную группу обозначают префиксом “гидрокси-“ (иногда “окси-”). По радикально-функциональной номенклатуре алканолы называются спиртами, например:
Изомерия алканолов определяется местонахождением гидроксильных групп и разветвлением углеродной цепи. Начиная с бутанола -2, имеет место также стереоизомерия, т.к. появляется хиральный атом углерода.
Методы получения
1. Гидратация алкенов
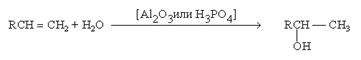
2. Гидроборирование алкенов
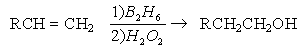
3. Гидролиз галогеналканов
2RCl + Na2CO3 +H2O 2ROH + 2CO2 + 2NaCl
4. Гидрирование карбонильных соединений.
а) Восстановление водородом
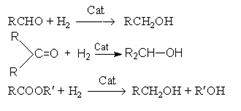
Катализаторами этих процессов являются Ni, Pt, Pd.
б) Восстановление алкоголятами

5. Взаимодействие карбонильных соединений с реактивом Гриньяра
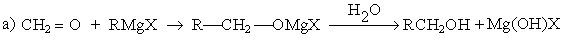
Можно видеть, что используя в качестве реагента формальдегид получают первичные спирты, содержащие на один атом углерода больше, чем исходное карбонильное соединение.
б) В то же время, конденсация альдегидов (кроме формальдегида) с реактивами Гриньяра с последующим гидролизом приводит к образованию вторичных спиртов.
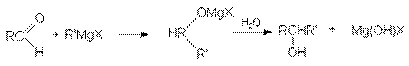
в) В свою очередь, конденсация кетонов с реактивами Гриньяра и последующий гидролиз приводит к образованию третичных спиртов.
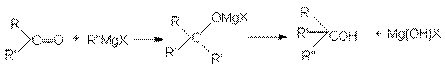
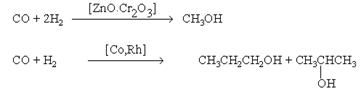
6. Синтез спиртов из синтез-газа
Физические свойства алканолов
Алканолы являются бесцветными жидкостями или кристаллическими веществами с характерным запахом. Первые члены ряда имеют приятный запах, для бутанолов и пентанолов запах становится неприятным и раздражающим. Высшие алканолы имеют приятный ароматический запах.
Отличительная черта алканолов - более высокая температура кипения, чем для соответствующих хлор-, бром- и иодалканов, несмотря на то, что молекулярные массы галогеналканов выше.
Кислотность
Спирты являются слабыми ОН - кислотами, которые проявляются во взаимодействии с сильными основаниями.
ROH + ОН RO + H2O
Это равновесие существенно смещено в левую сторону, т.к. RO- дестабилизирован из-за положительного индуктивного эффекта алкильной группы. Обычно для получения алкоголятов применяют реакцию активного металла с безводным спиртом.
2ROH + 2Na 2RONa + H2
6ROH + 2Al 2Al(OR)3 + 3H2
Высокая основность алкоголятов используется для успешного осуществления реакций дегидрогалогенирования и генерирования карбанионов и других анионов, играющих ключевую роль в реакциях конденсации органических соединений
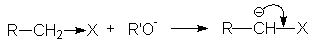
В тоже время алкоголят-анионы являются достаточно сильными нуклеофилами, что позволяет использовать их в качестве реагентов в некоторых важных реакциях нуклеофильного замещения, например, в синтезе простых и сложных эфиров.
RHal + R ONa R OR + NaHal
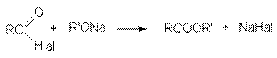
Основность
Неподеленная электронная пара на кислородном атоме гидроксильной группы обуславливает возможность взаимодействия его с электрофильными реагентами с образованием донорно-акцепторной связи, при этом кислородный атом приобретает положительный заряд и образуются оксониевые соединения:
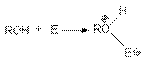
где E - кислота Льюиса, например BF3, AlCl3, PCl3, SOCl2, TiCl4, SnCl4, H+, NO2 и др.
Алканолы являются слабыми основаниями
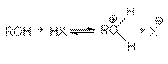
В присутствии сильных концентрированных кислот равновесие в достаточной степени смещено в правую сторону.
Последняя реакция обусловливает легкое отщепление уходящей группы, H2O, и это создает благоприятные условия для реакции нуклеофильного замещения, например, при синтезе простых эфиров.
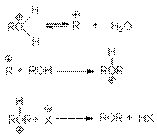

при замещении гидроксильной группы на галоген или другой кислотный остаток
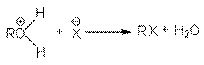
или суммарно:
ROH + HX RX + H2O
при алкилировании аренов спиртами
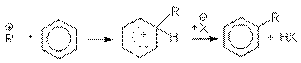
или суммарно:
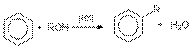
в реакции дегидратации спиртов
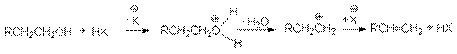
Дата добавления: 2017-04-05; просмотров: 3212;











