Химические свойства
Химическое поведение галогенуглеводородов определяется такими факторами как энергия связи С–Hal, полярность этой связи и ее поляризуемость. Так, относительная слабость связей С–Cl, C–Br и СJ обусловливает их предпочтительное гомолитическое расщепление по сравнению со связями С–С и С–Н. В то же время полярность связей С–Hal и их более высокая поляризуемость по сравнению со связями С–С и С–Н является предпосылкой для их гетеролитического расщепления. Приводимые ниже реакции являются иллюстрацией этих положений.
1. Замещение галогена на водород.
Восстановление галогенпроизводных до углеводородов осуществляется водородом в присутствии обычных катализаторов гидрирования (Ni, Pt, Pd):
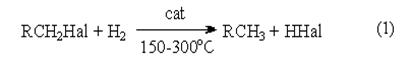
Реакция имеет гомолитический характер, связанный с предварительной сорбцией реагентов на поверхности катализатора, причем водород претерпевает диссоциативную адсорбцию с вовлечением адсорбированных атомов водорода в реакцию восстановления
Реакция (1) имеет важное практическое значение как метод переработки галогенорганических отходов в промышленном органическом синтезе. В отличие от другого метода обезвреживания галогенорганических отходов, сжигания, этот метод является ресурсосберегающим и экологически безопасным, так как при его реализации регенерируется углеводородная составляющая исходного сырья и исключается образование высокотоксичных полихлордибензодиоксинов и полихлордибензофуранов.
Другой метод замещения галогена на водород – взаимодействие галогенпроизводных углеводородов с иодоводородной кислотой при нагревании
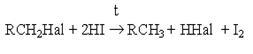
Метод имеет препаративное значение.
2. Взаимодействие с металлами.
а) реакция димеризации (синтез Вюрца)
2RHal + Na R–R + 2NaHal
Такой характер взаимодействия является выражением природы реагентов. Натрий как очень активный металл легко отдает свой электрон молекуле галогенуглеводорода, которая выступает в роли слабого электрофилаРеакция имеет препаративное значение.
б) Взаимодействие с магнием (реакция Гриньяра).
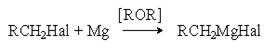
Механизм этой реакции в части ее инициирования подобен механизму реакции Вюрца
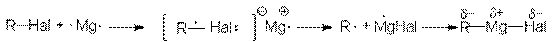
3. Реакции нуклеофильного замещения
Реакции нуклеофильного замещения – наиболее типичный круг реакций, в которых галогенуглеводороды выступают в качестве субстратов. Результатом этих реакций является замещение галогена на другой атом или группу, которые либо непосредственно выступают в роли нуклеофильного реагента, либо входят в его состав в качестве фрагмента.
Наиболее типичными реакциями нуклеофильного замещения галогеналканов и других галогенпроизводных являются:
а) реакции гидролиза
RHal + H2O ROH + HHal
RHal + NaOH ROH + NaHal
б) реакции образования простых эфиров (реакция Вильямсона)
RHal + R`ONa ROR` + NaHal
в) синтез сложных эфиров
R1Hal + RCOONa RCOOR1 + NaHal
г) аммонолиз
RHal + 2NH3 RNH2 + NH4Hal
д) синтез нитросоединений и нитритов
е) синтез нитрилов и изонитрилов
ж) синтез тиолов и сульфидов
R–Hal + NaSH RSH + NaHal
R–Hal + R1SNa RSR1 + NaHal
2R–Hal + Na2S RSR + 2NaHal
з) синтез фосфорорганических соединений
(CH3)2PH + CH3CH2Br + NaOH (CH3)2PCH2CH3 + NaBr + H2O
диметилэтилфосфин
и) синтез углеводородов на основе Mg-органических соединений
R–MgHal + R’Hal R–R’ + MgHal2
к) замещение галогена на галоген
RX + NaY RY + NaY
(см. подробно методы получения галогеналканов)
Из приведенных реакций можно видеть, что реакции нуклеофильного замещения могут служить методом образования связей С–С, С–О, С–S, C–N, C–P и C–Hal.
Дата добавления: 2017-04-05; просмотров: 1644;











