Бензол и другие ароматические углеводороды
Номенклатура. Бензол (циклогексатриен-1,3,5; старинное – «фен»). Его одновалентный радикал: фен + ил = фенил. Атомы 2 и 6 (Около старшего атома углерода - 1) – Орто-положения; атом - 4 (через ПАРу атомов от первого) - ПАРа-положение; атомы 3 и 5 (Между орто- и пара-) – Мета-положение (важно: относительно старшего атома углерода, при его смене меняются все положения):
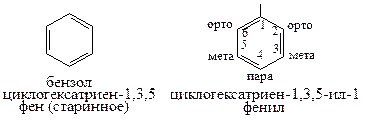
Строение бензола [1, с.384-386]. Валентное состояние атомов углерода в цикле – sp2. Молекула построена из шести треугольников, она плоская, все углы 120°, у каждого атома углерода есть р-орбиталь, шесть р-орбиталей образуют три π-связи. В результате сопряжения π-облака сливаются в два тороидальных облака (2 «бублика»), расположеных выше и ниже цикла.
Понятие «ароматический характер» [1, с.380-382]. Уже в 1825 г химики наблюдали, что бензол и другие соединения аналогичного строения, несмотря на высокую ненасыщенность, чрезвычайно инертны (присоединение водорода протекает медленно при 200°С/100 атм/Ni). Одновременно, эти углеводороды легко (0°С - 5°С) вступают в реакции ионного (электрофильного) замещения водорода: С6Н6 + Е+ → С6Н5Е + Н+, где Е+-электрофил, например, СН3+. Эти вещества не были похожи ни на один класс органических соединений. Поскольку они отличались специфическим ароматом их назвали «ароматические углеводороды» и отнесли к классу ароматических углеводородов. Особенности их химического поведения - так называемый «ароматический характер».
Признаки ароматичности органических соединений [1, с.387-396]. Ароматический характер – следствие образования стабильного циклического π-электронного облака. Эффективная стабилизация – результат резонанса π-электронов. Ароматическим характером обладают молекулы:
а) имеющие циклическое плоское строение;
б) имеющие у каждого атома, входящего в цикл - р-орбиталь или неподеленную электронную пару;
в) у которых суммарное число электронов в циклическом π-облаке, равно (4n+2), где n – 0, 1, 2, … Примеры органических соединений ароматического ряда:
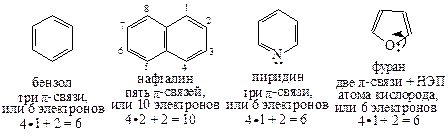
Неподеленная пара электронов (НЭП) атома азота фурана в результате сопряжения с π-облаком ядра включается в единое циклическое π-электронное облако. В то же время, НЭП пиридина не задействована. Пиридин, фуран и др. относятся к т.н. «небензоидным ароматическим системам». Все они, подобно бензолу, обладают ароматическим характером.
Реакции электрофильного замещения водорода в ароматическом ядре (SE). Урощенная схема написания реакций электрофильного замещения водорода в ароматическом ядре (SE): пишут структурные формулы участников, отсекают от них молекулу галогеноводорода или воды, остатки молекул соединяют. Карбоксильную группу вводят путем окисления любого углеводородного заместителя в ядре (за исключением заместителя ароматического характера).
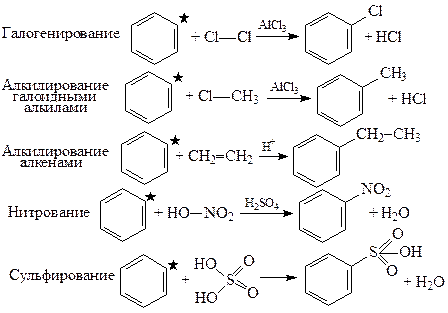
Механизм электрофильного замещения водорода в ароматическом ядре (SE), [1, 410-431].
На первой стадии реакции (SE) с участием катализатора образуется электрофил - катион Е+:
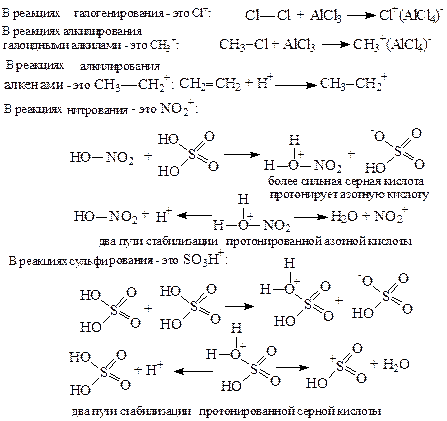
На второй стадии Е+ взаимодействует с π-облаком ядра с образованием π-комплекса, который на третьей стадии превращается в σ-комплекс. При образовании σ-комплекса ядро теряет 2 электрона и утрачивает ароматический характер. На четвертой стадии происходит восстановление ароматического характера ядра за счет возвращения в ядро двух электронов. При этом σ-комплекс превращается либо в исходный продукт (путь «а»), либо в продукт замещения (путь «б»).
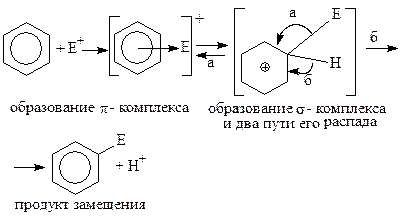
Правила ориентации в реакциях электрофильного замещения водорода в ароматическом ядре (SE). Заместители в ароматическом ядре нарушают однородность циклического π-электронного облака. Оно становится похожим на шарикоподшипник – у одних атомов углерода становится больше π-электронов, у других – меньше. Электрофил на стадии образования π-комплекса, направляется только к атомам углерода с повышенной электронной плотностью. Различают заместители I рода (электронодоноры) и II рода (электроноакцепторы).
Заместители I рода увеличивают электронную плотность в ядре либо: а) за счет сопряжения электронов своих НЭП или π-электронов кратных связей (+Мэфф), (это – NH2, OH, Cl, Br, СН=СН2, С≡СН, С6Н5), либо: б) за счет +Jэфф, (это – алкильные группы). Заместители I рода увеличивают электронную плотность в орто- и пара- положениях ядра. Атомы галогенов проявляют одновременно оба эффекта (+Мэфф и +Jэфф), причем +Мэфф преобладает.
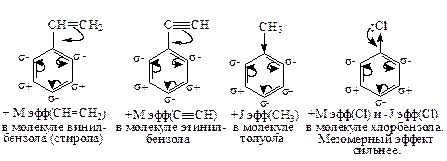
Заместители первого рода ускоряют реакцию замещения (SE) за счет увеличения электронной плотности в ядре и ускорения стадии образования π-комплекса, исключение – заместители галогены.
В случае заместителей электроноакцепторов - все наоборот: они обладают отрицательным индуктивным эффектом (-Jэфф) и создают избыток электронной плотности в мета-положении. Именно в мета-положение и направляется Е+. Примеры заместителей II рода: NO2, SO3H, COOH, CN, C=O в альдегидах и кетонах. Заместители II рода замедляют реакцию замещения (SE) за счет замедления скорости образования π-комплекса.
При наличии в ядре нескольких заместителей, каждый ориентирует вне зависимости от других заместителей. Алгоритм решения задач на введение в одно ядро нескольких заместителей сводится к определению последовательности введения заместителей.
Реакции ароматических углеводородов по заместителю протекают в соответствии с природой заместителя: в заместителях алкилах (СН3 и т.д.) – идет замещение водорода как в алканах (радикальный механизм), в алкенилах (СН=СН2 и т.д.) идут реакции по π-связи как в алкенах (ионный механизм), в алкинилах (С≡СН и т.д.) идут реакции по π- и по С-Н связям как в алкинах (ионный механизм). В случае алкильных заместителей все реакции начинаются с замещения водорода на α-углероде. Это обусловлено образованием при его отрыве радикала очень устойчивого вследствие делокализации неспаренного электрона на 7 атомах (1 α-С и 6 углеродов ядра). Вспомните: аналогичная ситуация с делокализацией неспаренного электрона на трех атомах углерода описана для реакции замещения водорода в аллильном положении.
ТЕМА 9
Изолированные
Дифенил получают пиролизом бензола или действием натрия на иодбензол. Ди- и трифенилметаны легко получают реакцией Фриделя – Крафтса из ди- или трихлорметана и бензола, а также из фенилхлорметана или фенилдихлорметана и бензола. Ввести по реакции Фриделя-Крафтса четыре объемных заместителя, четыре фенила к одному атому углерода трудно. Его получают отдельной реакцией.
Водород на α-углероде в алкил замещенных бензолах подвижен. В молекулах ди- и трифенилметанов подвижность водорода еще выше, так как при его отрыве образуются еще более устойчивые промежуточные частицы на которых свободная валентность делокализована уже на 13 или 19 атомах углерода. Так, например, устойчивость трифенилметильного радикала настолько высока, что его можно получить и хранить в виде разбавленных растворов.
По той же причине для трифенилметана и его производных легко протекают самые разнообразные реакции по α-углероду:
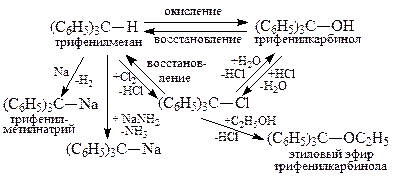
ТЕМА 10
Конденсированные
Особенности химических свойств нафталина
1. Наиболее активные положения в молекуле – α-положения (1, 4, 5, 8).
Все реакции электрофильного замещения водорода в нафталине начинаются с них и протекают аналогично SE реакциям в бензоле. В случае реакции сульфирования наблюдается миграция сульфогруппы из α- в β-положение (изомеризация), которая протекает при высокой температуре. Изомеризация сульфогруппы протекает независимо от наличия в молекуле нафталина других заместителей.
2. Один цикл молекулы нафталина обладает 100 % ароматическим характером (содержит в циклическом π-облаке шесть π-электронов), одновременно другой цикл проявляет двойственную реакционную способность – ведет себя как ароматическое ядро и как сопряженный диен (содержит четыре π-электрона).
Поэтому по второму кольцу молекулы нафталина, помимо реакций замещения водорода (SE) возможны реакции присоединения (1,4-присоединение) и окисления (как сопр диен) как в сопряженных диенах. Например, гидрирование, галогенирование, окисление (в жестких условиях).
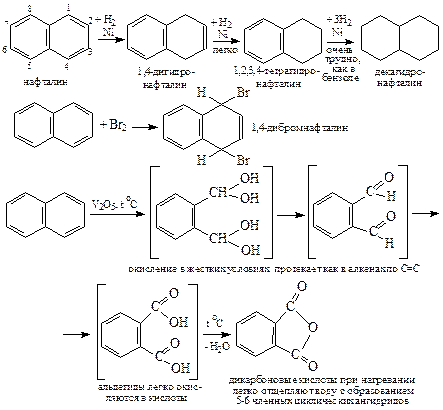
3. Два тороидальных циклических π-электронных облака нафталина соприкасаются и образуют фигуру в форме «восьмерки», однако «перетекание» π–электронов из одного облака в другое не происходит.
Реакции (SE) электрофильного замещения водорода в нафталине. Правила ориентации. Первый заместитель (безразлично I или II рода) всегда замещает водород в одном из α-положений. Механизм реакций (SE) замещения и написание уравнений реакций – как в случае бензола.
Заместители I рода (электронодоноры), расположенные в α- или β-положениях увеличивают электронную плотность только в своем ядре, поэтому следующий заместитель направляется именно в это ядро, причем в самое активное – α-положение (в случае если первый заместитель расположен в β-положении, второй направляется преимущественно в соседнее с ним α-положение).
Заместители II рода (электроноакцепторы), расположенные в α- или β-положениях, уменьшают электронную плотность только в своем ядре, поэтому следующий заместитель направляется в соседнее ядро, причем также в самые активные - α-положения с образованием смеси двух продуктов.
Дата добавления: 2016-06-15; просмотров: 2972;











