Арены и углеводороды смешанного строения
Арены, или ароматические углеводороды, - соединения, содержащие в молекуле особую циклическую группировку из шести атомов углерода, которая называется бензольной группировкой (бензольное ядро):
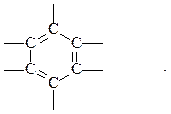
бензольное ядро
Название углеводородов этой группы «ароматические соединения» - случайное и сегодня потеряло свой первоначальный смысл. Действительно, первые открытые соединения или обладали специфическим, иногда приятным запахом, или были выделены из природных сильно пахнущих продуктов. Но количество «ароматных» веществ среди многочисленных известных соединений этой группы невелико. В то же время наблюдается ряд особенностей в строении, физических свойствах и химическом поведении этих веществ, связанных с наличием в молекуле бензольных группировок.
Различают одноядерные (одна бензольная группировка в молекуле) и многоядерные ароматические углеводороды, содержащие две или более бензольные группировки. В молекулах аренов в качестве боковых цепей могут находиться углеводородные радикалы с неразветвлённой или разветвлённой углеродной цепочкой, а также содержащие двойные или тройные связи и циклические группировки:
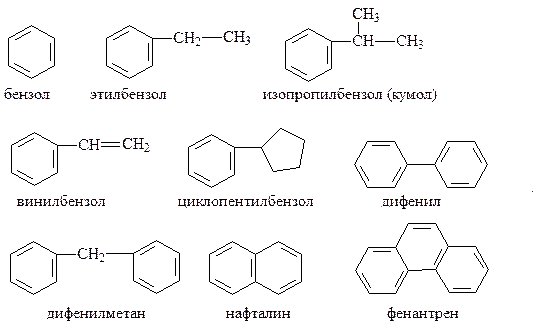
Следовательно, арены могут содержать в молекуле наряду с ароматическими ядрами разнообразные по строению алифатические цепи, а также включать в состав молекулы другие (не содержащие ядер бензола) циклические группировки.
Первый и один из наиболее важных представителей гомологического ряда одноядерных ароматических углеводородов – бензол С6Н6. Отсюда и общее название гомологического ряда – ряд бензола.
Строение бензола.Общая формула моноциклических аренов CnH2n-6 показывает, что они являются ненасыщенными соединениями.
В 1865 г. немецкий химик А.Ф. Кекуле предложил циклическую формулу бензола с сопряжёнными связями (чередуются простые и двойные связи) – циклогексатриен-1,3,5:
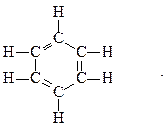
Такая структура молекулы бензола не объясняла многие свойства бензола:
1) Для бензола характерны реакции замещения, а не присоединения, свойственные ненасыщенным соединениям. Реакции присоединения возможны, но протекают труднее, чем для алкенов.
2) Бензол не вступает в реакции, являющиеся качественными реакциями на непредельные УВ (с бромной водой и раствором KMnO4).
Чтобы выйти из этого затруднения, Кекуле был вынужден допустить возможность постоянного изменения положения двойных связей в молекуле бензола, т.е. выдвинул теорию "осцилляции«, согласно которой двойные связи не фиксированы на одном месте:
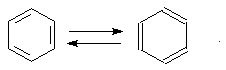
Проведённые позже электронографические исследования показали, что все связи между атомами углерода в молекуле бензола имеют одинаковую длину 0,140 нм (среднее значение между длиной простой связи С-С 0,154 нм и двойной связи С=С 0,134 нм). Угол между связями у каждого атома углерода равен 1200. Молекула представляет собой правильный плоский шестиугольник.
Современная теория для объяснения строения молекулы С6Н6 использует представление о гибридизации орбиталей атома углерода.
Атомы углерода в бензоле находятся в состоянии sp2-гибридизации. Каждый атом «С» образует три σ-связи (две с атомами углерода и одну с атомом водорода). Все σ-связи находятся в одной плоскости:
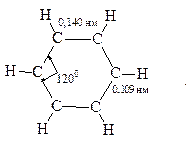
Каждый атом углерода имеет один р-электрон, который не участвует в гибридизации. Негибридизированные р-орбитали атомов углерода находятся в плоскости, перпендикулярной плоскости σ-связей. Каждое р-облако перекрывается с двумя соседними р-облаками, и в результате образуется единая сопряжённая π-система (рис. 8).
 |
а) б)
Рис.8. Взаимное перекрывание 2р-орбиталей в молекуле бензола:
а – вид сбоку; б – вид сверху
В результате такого равномерного перекрывания 2р-орбиталей всех шести углеродных атомов происходит «выравнивание» простых и двойных связей, т.е. в молекуле бензола отсутствуют классические двойные и одинарные связи. Равномерное распределение π-электронной плотности между всеми углеродными атомами, обусловленное π-электронным сопряжением, и является причиной высокой устойчивости молекулы бензола.
В настоящее время нет единого способа графического изображения молекулы бензола с учётом его реальных свойств. Практически это и невозможно сделать. Но чтобы подчеркнуть выравненность π-электронной плотности в молекуле бензола, прибегают к помощи следующих формул:
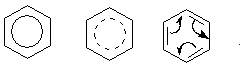
Таким образом, по современным данным все связи между атомами углерода в кольце бензола одинаковы и по длине занимают промежуточное положение между одинарными и двойными. Однако в конденсированных аренах не все межатомные связи в кольце сохраняют равнозначность, вследствие чего для них применяется более общее изображение с тремя двойными связями.
Дата добавления: 2016-12-09; просмотров: 3685;











