Произведение растворимости
Закон действующих масс применим как к гомогенным равновесиям, например, к равновесиям в растворах, так и к равновесиям в гетерогенных системах.
Гетерогенная (неоднородная) система – это система, состоящая из нескольких гомогенных фаз, разделенных между собой поверхностью раздела. Свойства фаз отличаются друг от друга и примерами таких гетерогенных систем могут являться две несмешивающиеся жидкости, осадок и насыщенный раствор над ним, газ и твердое вещество и др. Равновесие, устанавливающееся в гетерогенной системе на границе раздела фаз, называется гетерогенным равновесием. Гетерогенная система «осадок – раствор» представляет собой осадок малорастворимого соединения, например, сульфата бария BaSO4, находящийся в равновесии с его насыщенным раствором:
BaSO4 (т) ↔ Ba2+ + SO42- (р)
Напомним, что насыщенным называется раствор, содержащий максимальное количество вещества, которое может раствориться в данном объеме раствора при данной температуре и давлении. Насыщенный раствор устойчив во времени.
Пересыщенный раствор – это раствор, в котором содержится бóльшее количество вещества, чем в насыщенном. Такой раствор неустойчив и избыток вещества выделяется из него в твердую фазу, то есть образуется осадок. Процесс протекает до образования над осадком насыщенного раствора.
Ненасыщенный раствор характеризуется меньшим количеством растворенного вещества, чем насыщенный, и в нем может быть растворено дополнительное количество вещества до получения насыщенного раствора.
Концентрация вещества в насыщенном растворе называется растворимостью. Растворимость является количественной характеристикой способности вещества растворяться. Различают молярную и массовую растворимость вещества.
Молярная растворимость вещества (S, моль/л) – это количество растворенного вещества, содержащееся в одном литре его насыщенного раствора:
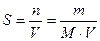 ,
,
где: n – количество растворенного вещества, моль
m – масса растворенного вещества, г
M – молярная масса растворенного вещества, г/моль
V – объем насыщенного раствора, л .
Массовая растворимость вещества (Т, г/л) – это масса растворенного вещества, содержащаяся в одном литре его насыщенного раствора:
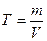
где: m – масса растворенного вещества, г
V – объем насыщенного раствора, л
Молярная и массовая растворимости связаны между собой соотношением:
Т = S∙M
Вещества, молярная растворимость которых не превышает 10-2 моль/л, обычно считают малорастворимыми. Примерами малорастворимых солей могут служить сульфат бария BaSO4, карбонат кальция СаСО3, хлорид серебра AgCl, сульфид цинка ZnS, растворимость которых в воде очень мала.
В гетерогенной системе «осадок-раствор» на поверхности раздела твердой и жидкой фаз протекают два противоположно направленных процесса – переход молекул малорастворимого вещества в раствор (растворение) и обратный процесс перехода молекул вещества в осадок (осаждение). Если оба процесса протекают с одинаковой скоростью, в гетерогенной системе «осадок – раствор» на поверхности раздела твердой фазы и раствора устанавливается динамическое химическое равновесие между молекулами вещества в осадке и растворе.
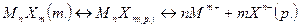
Молекулы малорастворимого сильного электролита, перешедшие в раствор, полностью распадаются на ионы и его непродиссоциированных молекул в растворе нет. Поэтому в гетерогенной системе «осадок – раствор» устанавливается равновесие между молекулами малорастворимого вещества в осадке и его ионами в насыщенном растворе:
MnXm (т) ↔ nMm+ + mXn- (р)
Для этого химического равновесия можно написать выражение истинной термодинамической константы химического равновесия:
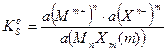
Активность твердого вещества а(MnXm(т)) принимается постоянной и равной единице, тогда:
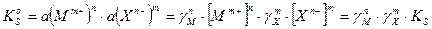
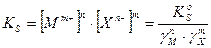
где: 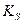 и
и 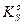 - концентрационное и термодинамическое произведение растворимости (ПР)
- концентрационное и термодинамическое произведение растворимости (ПР)
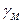 и
и 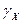 – коэффициенты активности катиона и аниона.
– коэффициенты активности катиона и аниона.
Из выше приведенных выражений следует правило произведения растворимости: произведение активностей ионов в степенях, равных стехиометрическим коэффициентам, в насыщенном растворе малорастворимого электролита есть величина постоянная для данного растворителя, температуры, давления.
Это правило справедливо как для сильных, так и для слабых электролитов, как для идеальных, так и для реальных систем. В реальных системах, однако, вместо активностей удобнее использовать концентрации. Соответственно, вместо термодинамического произведения растворимости 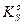 используют концентрационное произведение растворимости – реальное (
используют концентрационное произведение растворимости – реальное ( 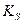 ). Термодинамические произведения растворимости (
). Термодинамические произведения растворимости ( 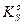 ) приведены в справочниках. Для гетерогенного равновесия «осадок-раствор» в воде, когда концентрации катиона и аниона в насыщенном растворе над осадком очень малы и ионная сила раствора практически равна нулю, их коэффициенты активности стремятся к единице, то
) приведены в справочниках. Для гетерогенного равновесия «осадок-раствор» в воде, когда концентрации катиона и аниона в насыщенном растворе над осадком очень малы и ионная сила раствора практически равна нулю, их коэффициенты активности стремятся к единице, то 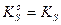 .
.
Для расчета растворимости малорастворимого соединения используют выражение для концентрационного произведения растворимости ( 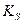 ). Если S – молярная растворимость малорастворимой соли
). Если S – молярная растворимость малорастворимой соли 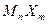 , тогда в соответствии с равновесием
, тогда в соответствии с равновесием
MnXm ↔ nMm+ + mXn-
равновесные концентрации катиона и аниона в насыщенном растворе будут равны:
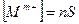 и
и 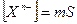
Подставив эти значения в выражение для концентрационного произведения растворимости, получим:
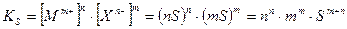
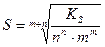
Если ионная сила раствора мала и коэффициенты активности катиона и аниона стремятся к единице, то можно вместо концентрационного произведения растворимости ( 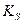 ) использовать непосредственно табличное значение
) использовать непосредственно табличное значение 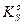 . По данной формуле можно рассчитать молярную растворимость любого малорастворимого вещества в воде.
. По данной формуле можно рассчитать молярную растворимость любого малорастворимого вещества в воде.
Растворимость малорастворимого соединения зависит от его природы и природы растворителя, температуры, давления, присутствия в растворе других электролитов (как имеющих, так и не имеющих одноименные ионы с данным малорастворимым соединением), а также различных веществ, вступающих с ионами осадка в реакции нейтрализации, комплексообразования и другие химические реакции.
Произведение растворимости является одной из основных характеристик малорастворимых электролитов и по значению ПР:
1. можно рассчитать условия осаждения;
2. определить растворимость данного осадка в данных условиях;
3. выяснить какой осадок будет выпадать первым.
Из всего сказанного вытекают два следствия:
I. а) Если произведение концентрации ионов (ИП) меньше величины произведения растворимости (ПР), то раствор ненасыщен относительно данного труднорастворимого соединения и осадок не образуется;
б) если произведение концентрации ионов (ИП) равно произведению растворимости (ПР), то раствор насыщен относительно данного труднорастворимого соединения; в растворе наступает подвижное равновесие и осадок не выпадает;
в) Если произведение концентрации ионов (ИП) больше произведения растворимости (ПР), то раствор пересыщен относительно данного труднорастворимого соединения и осадок образуется. Осадок выделяется до тех пор, пока не будет достигнута величина ПР.
II. Из двух труднорастворимых соединений в первую очередь выпадет в осадок тот, чье произведение растворимости (ПР) будет наименьшим.
ЛЕКЦИЯ № 3
План лекции:
1. Поведение сильных и слабых одноосновных кислот в водных растворах.
2. Поведение сильных и слабых однокислотных оснований в водных растворах.
3. Поведение сильных и слабых многоосновных кислот в водных растворах.
Дата добавления: 2017-04-05; просмотров: 6181;











