Поведение сильных и слабых однокислотных оснований в водных растворах.
1. Сильные однокислотные основания(МОН) диссоциируют в водных растворах нацело (α = 1) и рН в растворах таких оснований определяется исходной концентрацией основания С(МОН):
МОН → М+ + ОН-
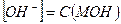 и
и 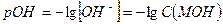
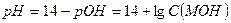
Сильными однокислотными основаниями являются гидроксиды щелочных металлов – LiOH, NaOH, KOH. Например, в 0,1 М растворе NaOH:
NaOH → Na+ + OH- и рОН = -lgC(NaOH) = -lg0,1 = 1 и рН = 14 - 1 = 13
2. Слабые однокислотные основания(ВОН) диссоциируют в водных растворах частично и при этом устанавливается динамическое химическое равновесие: ВОН ↔ В+ + ОН-, которое характеризуется соответствующей константой равновесия – константой основной диссоциации Kb:
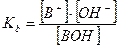
При условии, что 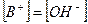 и
и 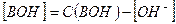 , имеем:
, имеем:
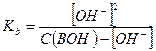
Где 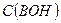 - исходная концентрация основания в растворе.
- исходная концентрация основания в растворе.
Константа основной диссоциации Kb (или ее показатель pKb = -lgKb) характеризует силу основания – чем меньше значение Kb (больше pKb), тем слабее основание, и наоборот. Например, анилин (Kb = 4,3∙10-10, рKb = 9,37) слабее, чем аммиак (Kb = 1,75∙10-5, рKb = 4,75).
Если степень диссоциации α < 0,1, величиной 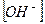 в знаменателе можно пренебречь, тогда:
в знаменателе можно пренебречь, тогда:
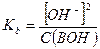
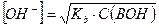
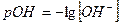 и
и 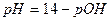
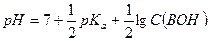
Степень диссоциации слабого основания следует рассчитывать в соответствии с определением данной величины:
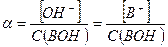
Примерами слабых однокислотных оснований являются AgOH, CuOH, NH4OH (водный раствор аммиака, NH3∙H2O), водные растворы анилина (C6H5NH2) и других органических аминов. Например, для 0,1 М раствора NH4OН:
NH4OH ↔ NH4+ + OH-
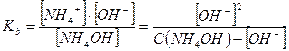
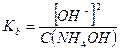
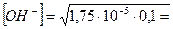
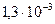 моль/л
моль/л 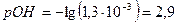

При этом 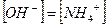 и степень диссоциации основания
и степень диссоциации основания

Дата добавления: 2017-04-05; просмотров: 1692;











