Действие одноименных ионов
Степень электролитической диссоциации вещества зависит не только от его концентрации в растворе, но и от присутствия в растворе других электролитов. Степень диссоциации слабого электролита понижается при введении в раствор сильного электролита, содержащего одноименный (т.е. общий) ион с исходным электролитом. Влияние одноименного иона легко объясняется с позиций закона ЗДМ.
Рассмотрим равновесие в растворе аммиака:
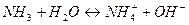
Константу равновесия этой реакции можно представить уравнением
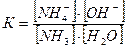
Если к раствору аммиака прилить сильный электролит, содержащий одноименные ионы, например, хлорид или нитрат аммония, то концентрация катионов NH4+ повысится во много раз. Благодаря этому числитель уравнения возрастает и величина дроби станет больше константы диссоциации. Нарушенное таким образом равновесие будет восстанавливаться в результате соединения ионов NH4+ и OH- в недиссоциированные молекулы NH4OH.
Следовательно, степень диссоциации слабого электролита понижается при введении в раствор какого-либо сильного электролита, содержащего одноименный с ним ион.
В рассмотренном случае концентрация ионов OH- понизится и раствор аммиака в присутствии NH4Cl или NH4NO3 будет вести себя как еще более слабое основание. Для понижения концентрации ионов H+ в растворе уксусной кислоты достаточно прибавить к нему немного соли этой кислоты, например, ацетата натрия, содержащей одноименный ион CH3COO-.
В аналитической химии иногда необходимо поддерживать в исследуемом растворе определенную, приблизительно постоянную концентрацию ионов 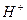 , которая не должна изменяться при хранении, разбавлении раствора, добавлении к нему небольших количеств сильной кислоты или щелочи.
, которая не должна изменяться при хранении, разбавлении раствора, добавлении к нему небольших количеств сильной кислоты или щелочи.
Свойства некоторых растворов сохранять практически постоянную концентрацию ионов водорода при добавлении небольших количеств кислоты, щелочи, а также при разбавлении, называют буферным действием, а растворы, которые обладают таким свойством – буферными растворами. Они представляют собой смеси электролитов, содержащие одноименные ионы. Например, ацетатный буферный раствор – смесь уксусной кислоты и ацетата натрия 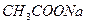 , аммонийный буферный раствор – смесь
, аммонийный буферный раствор – смесь 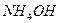 и
и 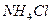 .
.
В качестве примера рассмотрим ацетатную буферную смесь, состоящую из слабой кислоты ( 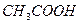 ) и сопряженного с ней основания (
) и сопряженного с ней основания ( 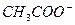 ). В растворе, содержащем сопряженную пару, устанавливаются следующие равновесия
). В растворе, содержащем сопряженную пару, устанавливаются следующие равновесия
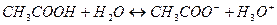
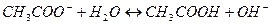 .
.
Добавление к буферному раствору щелочи приводит к связыванию 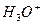 и ионизации новых молекул уксусной кислоты, что восстановит состояние исходной буферной системы. Добавление кислоты приведет к связыванию ацетат-ионов, полученных в результате ионизации соли, в молекулу слабого электролита – уксусную кислоту
и ионизации новых молекул уксусной кислоты, что восстановит состояние исходной буферной системы. Добавление кислоты приведет к связыванию ацетат-ионов, полученных в результате ионизации соли, в молекулу слабого электролита – уксусную кислоту
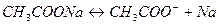
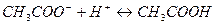
Таким образом, сильная кислота заменяется слабой, уксусной и, как следствие,  концентрация ионов водорода изменяется мало. Не происходит заметного изменения pH и при разбавлении ацетатного буферного раствора водой, т.к. концентрации слабой кислоты и сопряженного с ней основания изменяются пропорционально.
концентрация ионов водорода изменяется мало. Не происходит заметного изменения pH и при разбавлении ацетатного буферного раствора водой, т.к. концентрации слабой кислоты и сопряженного с ней основания изменяются пропорционально.
При добавлении щелочи к аммонийному буферному раствору, состоящего из раствора аммиака и хлорида аммония, концентрация ионов 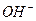 должна сильно увеличиться. Но так как аммонийный буферный раствор содержит большое число катионов
должна сильно увеличиться. Но так как аммонийный буферный раствор содержит большое число катионов 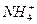 , образуемых при диссоциации хлорида аммония:
, образуемых при диссоциации хлорида аммония:
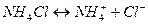 ,
,
эти катионы связывают ионы 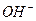 c образованием малодиссоциированных молекул
c образованием малодиссоциированных молекул 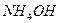 . Таким образом, концентрация ионов
. Таким образом, концентрация ионов 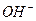 в растворе не увеличивается и величина pH остается практически постоянной.
в растворе не увеличивается и величина pH остается практически постоянной.
При взаимодействии компонентов аммонийного буферного раствора с сильной кислотой ионы 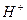 соединяются с ионами
соединяются с ионами 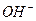 гидроксида аммония (
гидроксида аммония ( 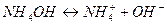 ) и образуют малодиссоциирующие молекулы воды. Расход ионов
) и образуют малодиссоциирующие молекулы воды. Расход ионов 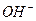 возмещается диссоциацией
возмещается диссоциацией 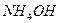 , и pH раствора почти не изменяется. Следовательно, при добавлении к аммонийному буферному раствору небольших количеств щелочи или сильной кислоты pH раствора практически не изменяется.
, и pH раствора почти не изменяется. Следовательно, при добавлении к аммонийному буферному раствору небольших количеств щелочи или сильной кислоты pH раствора практически не изменяется.
Количественной характеристикой способности буферного раствора поддерживать заданную величину pH является буферная емкость, под которой понимают количество молей сильной кислоты или сильного основания, прибавление которого к 1 л буферного раствора изменяет его pH на единицу.
Варьируя концентрацию слабой кислоты и ее соли, удается получить буферные растворы с заданными величинами pH.
В животных и растительных организмах также действуют сложные буферные системы, поддерживающие постоянными значения pH крови, лимфы и других жидкостей. Буферными свойствами обладает и почва, которая способна противостоять внешним факторам, изменяющим pH почвенного раствора, например, при введении в почву кислот или оснований.
Дата добавления: 2017-04-05; просмотров: 5015;











