Протолитические равновесия в растворах солей (гидролиз солей).
Гидролиз солей – это взаимодействие ионов растворенной соли с молекулами воды (ионами Н+ и ОН-, возникающими при диссоциации воды Н2О ↔ Н+ + ОН-), в результате которого образуются малодиссоциированные соединения (слабые кислоты и слабые основания). Реакция гидролиза процесс обратимый и в растворе устанавливается химическое равновесие между продуктами реакции и исходным соединением, которое характеризуется соответствующей константой равновесия – константой гидролиза Kh.
Количественно гидролиз характеризуется степенью гидролиза h, которая равна отношению числа прогидролизровавшихся частиц nгидр к общему числу исходных ионов nисх и численно выражается в долях единицы или процентах(%):
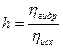 или
или 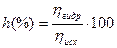
Степень гидролиза увеличивается с уменьшением концентрации гидролизующейся соли (разбавлением) и с ростом температуры (нагревание).
Соли, содержащие катионы сильных оснований и анионы сильных кислот (например, NaCl, KNO3, Li2SO4, NaClO4, BaCl2, CaBr2 и др.), не гидролизуются, так как не происходит связывания ионов Н+ и ОН-, возникающих в результате диссоциации воды. Водные растворы таких солей имеют нейтральную реакцию (рН = 7).
Гидролизу в водных растворах подвергаются соли, содержащие катионы слабых оснований и анионы слабых кислот.
1. Гидролиз солей, содержащих катион сильного основания и анион слабой одноосновной кислоты (МА). Такие соли нацело диссоциируют в водном растворе с образованием катиона сильного основания М+ и аниона слабой кислоты А-:
МА → М+ + А-
Анион слабой кислоты гидролизуется по уравнению:
А- + Н2О ↔ НА + ОН-
Так как в этом случае при гидролизе образуются слабая кислота (НА) и сильное основание (ОН-), то водные растворы такого типа солей имеют щелочную реакцию (рН > 7). В соответствии с принципом Ле-Шателье, чтобы подавить гидролиз в анализируемый раствор прибавляют сильное основание (щелочь), а усиление гидролиза достигается добавлением сильной кислоты (кислотный гидролиз).
Концентрационная константа равновесия реакции гидролиза аниона слабой кислоты имеет вид:
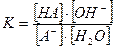
Так как 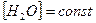 , то
, то
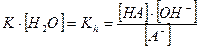
Полученная константа Kh есть константа гидролиза аниона слабой кислоты. Если умножить числитель и знаменатель полученного выражения на  получим:
получим:
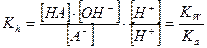 ,
,
Где Ка – константа диссоциации слабой кислоты HA.
Таким образом, анион слабой одноосновной кислоты A- является сопряженным с кислотой НА слабым основанием с константой основности Kb, равной константе его гидролиза Kh. При этом, чем слабее образующаяся в результате гидролиза кислота (меньше Ka), тем более сильным основанием является анион этой кислоты и тем в большей степени идет гидролиз.
Примерами солей гидролизующихся по описанному типу являются НСООK, СН3СООNa, KNO2, NaF, LiClO, KCN, С6Н5ОNa и др.
Поскольку такого типа соли ведут себя при гидролизе как слабые основания, их применяют в практике химического анализа для снижения кислотности среды. Например, при обнаружении и отделении ионов бария по реакции с дихроматом калия происходит сильное подкисление реакционной смеси, что препятствует образованию желтого осадка хромата бария:
2Ba2+ + Cr2O72- + H2O ↔ 2BaCrO4↓ + 2H+
Для создания в растворе значения рН = 4-5, необходимого для полного осаждения ионов бария, добавляют ацетат натрия. При этом избыток СН3СООNa способствует образованию ацетатной буферной смеси, поддерживающей необходимое значение рН.
2. Гидролиз солей, содержащих катион слабого однокислотного основания и анион сильной кислоты (ВХ). Такие соли нацело диссоциируют в водном растворе с образованием катиона слабого основания В+ и аниона сильной кислоты Х-:
ВХ → В+ + Х-
Катион слабого основания гидролизуется по уравнению:
В+ + Н2О ↔ ВОН + Н+
Так как при этом в реакции гидролиза образуются слабое основание (ВОН) и сильная кислота (Н+), то водные растворы такого типа солей имеют кислую реакцию (рН < 7). В соответствии с принципом Ле-Шателье, чтобы в этом случае подавить гидролиз в анализируемый раствор прибавляют сильную кислоту, а усиление гидролиза достигается добавлением сильного основания (щелочной гидролиз).
Константа гидролиза в этом случае будет
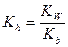 ,
,
где 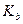 - константа диссоциации слабого основания.
- константа диссоциации слабого основания.
Таким образом, катион слабого однокислотного основания В+ является сопряженной с основанием ВОН слабой кислотой, с константой кислотности Kа, равной константе его гидролиза Kh. При этом, чем слабее образующееся в результате гидролиза основание (меньше Kb), тем более сильной кислотой является катион этого основания и тем в большей степени идет гидролиз.
Примерами солей гидролизующихся по описанному типу являются NH4Cl, AgNO3, соли органических аминов (например, CH3NH3NO3, (C2H5)2NH2Cl, C6H5NH3Cl и др.).
Поскольку такого типа соли ведут себя при гидролизе как слабые кислоты, их применяют в практике химического анализа для подкисления щелочных растворов. Например, при обнаружении ионов алюминия к сильно щелочному раствору, содержащему гидроксокомплекс алюминия (рН > 10), добавляют хлорид аммония до достижения значения рН = 9, при котором образуется белый аморфный осадок гидроксида алюминия:
[Al(OH)4]- + NH4+ → Al(OH)3↓ + NH4OH
При этом избыток NH4Cl способствует образованию аммонийной буферной смеси, поддерживающей необходимое значение рН.
3. Гидролиз солей, содержащих катион слабого однокислотного основания и анион слабой одноосновной кислоты (ВА). Гидролиз такого типа солей происходит с участием обоих ионов, входящих в состав соли:
В+ + А- + Н2О ↔ ВОН + НА
При этом кислотность раствора определяется силой образовавшихся кислоты и основания. Если кислота НА сильнее, чем основание ВОН (Ka > Kb), то есть она диссоциирует в большей степени, чем основание, то среда будет кислая (рН < 7), и наоборот, при Kb > Ka – щелочная (рН > 7). Когда сила кислоты и основания равны (Ka = Kb), например, в случае гидролиза ацетата аммония CH3COONH4, реакция раствора нейтральная (рН = 7).
В этом случае константа гидролиза имеет вид:
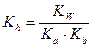
Примерами солей гидролизующихся по описанному типу являются NH4CN, NH4ClO, AgNO2, CH3COONH4, C6H5NH3F и др.
4. Гидролиз солей, содержащих катион сильного однокислотного основания и анион слабой многоосновной кислоты (МnА). Гидролиз такого типа солей разберем на примере соли двухосновной кислоты М2А, так как применяемые при этом допущения и методы расчета справедливы и для солей кислот большей основности. Соли М2А нацело диссоциируют в водном растворе с образованием катиона сильного основания М+ и аниона слабой двухосновной кислоты А2-, который гидролизуется ступенчато по уравнениям:
А2- + Н2О ↔ НА- + ОН- (I ступень)
НА- + Н2О ↔ Н2А + ОН- (II ступень)
Так как в этом случае при гидролизе образуются слабые кислоты (НА- и Н2А ) и сильное основание (ОН-), то водные растворы такого типа солей имеют щелочную реакцию (рН > 7). Как и в случае солей одноосновных слабых кислот в соответствии с принципом Ле-Шателье, чтобы подавить гидролиз в анализируемый раствор прибавляют сильное основание (щелочь), а усиление гидролиза достигается добавлением сильной кислоты.
Каждая ступень гидролиза характеризуется ступенчатой константой гидролиза, которые для первой и второй ступени имеют вид:
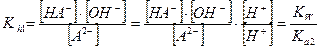
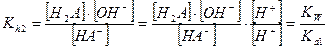
Так как Kа1 > Ka2, то Kh1 > Kh2. Поэтому при расчете равновесных концентраций частиц в растворе гидролизующейся соли М2А можно вторую ступень гидролиза не учитывать и все расчеты проводить по первой ступени, аналогично солям одноосновных слабых кислот МА.
Примерами солей гидролизующихся по описанному типу являются Na2S, K2CO3, Na2SO3, Na2C2O4 и др.
Аналогичным образом гидролизуются соли трехосновных кислот, например, K3PO4, Na3AsO4, Na3SbO3 и т.д. В этом случае гидролиз также преимущественно протекает по первой ступени и все расчеты проводят с использованием 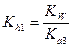 .
.
Дата добавления: 2017-04-05; просмотров: 2618;











