Поведение сильных и слабых одноосновных кислот в водных растворах.
1. Сильные одноосновные кислоты(НХ) диссоциируют в водных растворах нацело (α = 1) и рН в растворах таких кислот определяется исходной концентрацией кислоты С(НХ):
НХ → Н+ + Х-, Н+= С(НХ) и рН = -lg[H+] = -lgC(HX)
Сильными одноосновными кислотами являются HCl, HBr, HI, HNO3, HClO4, HMnO4.
Например, в 0,1 М растворе HCl:
HCl → H+ + Cl-
pH = -lgC(HCl) = -lg0,1 = 1.
2. Слабые одноосновные кислоты(НА) диссоциируют в водных растворах частично и при этом устанавливается динамическое химическое равновесие:
НА ↔ Н+ + А-
которое характеризуется соответствующей константой равновесия – константой кислотной диссоциации Kа:
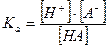
При условии, что 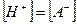 -и
-и 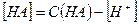 , имеем:
, имеем:
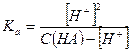
где С(НА) – исходная концентрация кислоты в растворе.
Константа кислотной диссоциации Kа (или ее показатель pKa = -lgKa) характеризует силу кислоты – чем меньше значение Ka (больше pKa), тем слабее кислота, и наоборот. Например, уксусная кислота (Ka = 1,74∙10-5, рKa = 4,76) слабее, чем муравьиная (Ka = 1,8∙10-4, рKa = 3,75).
Если α < 0,1 величиной 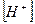 в знаменателе можно пренебречь, тогда:
в знаменателе можно пренебречь, тогда:
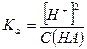
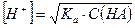 и
и 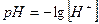
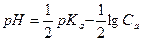
Степень диссоциации слабой кислоты следует рассчитывать в соответствии с определением данной величины:
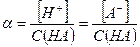
Примерами слабых одноосновных кислот являются НСООН, СН3СООН, HNO2, HF, HClO, HCN, С6Н5ОН, С6Н5СООН и др. Например, для 0,1 М раствора СН3СООН:
СН3СООН ↔ СН3СОО- + Н+
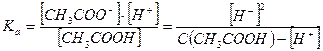
Если α < 0,1 величиной 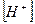 в знаменателе пренебрегают, тогда
в знаменателе пренебрегают, тогда
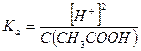
Отсюда 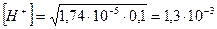 моль/л и
моль/л и 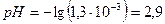
При этом 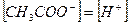 и степень диссоциации кислоты:
и степень диссоциации кислоты:
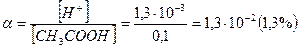
Дата добавления: 2017-04-05; просмотров: 2087;











