Условия образования щелочно-земельных накипей
Щелочно-земельные накипи образуются в тех случаях, когда в подогреваемой или испаряемой воде одновременно находятся катионы Са2+ и Mg2+ и анионы 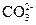 ,
, 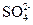 и
и 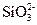 , с которыми они образуют труднорастворимые соединения:
, с которыми они образуют труднорастворимые соединения:
СаСО3, Mg(OH)2, CaSO4, Са(НСО3)2, Mg(НCO3)2, CaSiO3, MgSiO3, MgCO3.
Эти соединения выделяются в твердую фазу в результате физических и химических процессов. К физическим процессам относится постепенное повышение концентрации солей в котловой воде при продолжительном ее выпаривании, в результате чего наступает момент, когда достигается предел растворимости труднорастворимых солей и происходит выделение их в твердую фазу из пересыщенного раствора.
К химическим процессам накипеобразования относятся следующие:
а) термический распад кальция и магния:
Са(НСО3)2 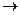 СаСО3 + Н2О + СО2; СаСО3 + Н2О + СО2;
| (4.7) |
Mg(HCO3)2 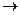 MgCO3 + H2O + CO2, MgCO3 + H2O + CO2,
| (4.8) |
в результате которого бикарбонаты кальция и магния преобразуются в менее растворимые карбонаты кальция и магния;
б) гидролиз карбоната магния, в результате которого последний переводится в еще менее растворимую гидроокись магния:
MgCO3 + 2 H2O 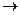 Mg(ОН)2 + H2CO3; Mg(ОН)2 + H2CO3;
| (4.9) |
в) реакции взаимного обмена, в результате которых образуются соли с меньшей растворимостью, например:
CaCl2 + Na2SiО3 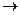 СаSiO3 + 2NaCl. СаSiO3 + 2NaCl.
| (3.10) |
Необходимо заметить, что из пересыщенных растворов выделяются в твердую фазу в первую очередь соли, имеющие отрицательный температурный коэффициент растворимости, которые откладываются на наиболее горячих поверхностях нагрева.
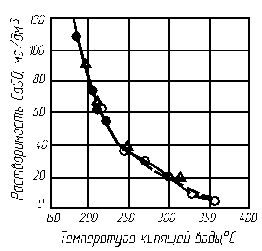
Рис. 4.2. Растворимость CaSO4 в зависимости от температуры воды
на линии насыщения:
● – по данным Патриджа; ○ – по данным Штрауба; Δ – по данным Резникова (МЭИ)
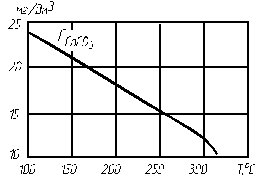
Рис. 4.3. Растворимость СаСО3 в зависимости от температуры воды
на линии насыщения
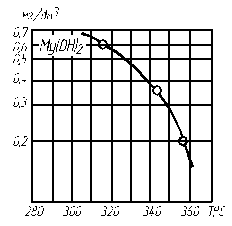
Рис. 4.4. Растворимость Mg(OH)2 в зависимости от температуры воды
на линии насыщения
На рис. 4.2–4.4 приведены кривые, характеризующие растворимость CaSO4, СаСО3 и Mg(OH)2 в зависимости от температуры воды. Скорость образования щелочно-земельной накипи пропорциональна концентрации ионов кальция и магния в растворе и резко возрастает с увеличением тепловой нагрузки поверхности нагрева:
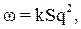
| (4.11) |
где ω– скорость образования накипи, мг/(см2·ч); k – коэффициент пропорциональности; S – концентрация накипеобразователей в котловой воде, мг/дм3;
q – плотность теплового потока, кВт/м2.
Дата добавления: 2017-03-12; просмотров: 2306;











