Условия образования твердой фазы из солевых растворов
Согласно современным представлениям, накипь и шлам образуются в результате физико-химических процессов, из которых основным является процесс кристаллизации, характеризующийся выделением твердой фазы из многокомпонентных солевых растворов. Выделение твердой фазы из раствора солей при его нагревании и кипячении может происходить различными путями, например, из пересыщенного раствора солей могут сначала отлагаться на отдельных участках поверхности металла первичные зародышевые кристаллы, которые затем укрупняются и разрастаются. Образование на поверхности металла первичных кристаллов накипи, являющихся своего рода связующим звеном между металлом стенки и слоем последующих твердых отложений, может быть объяснено тем, что поверхность металла обладает шероховатостью. Многочисленные бугорки на этой поверхности представляют собой центры кристаллизации твердой фазы из пересыщенного раствора. Кроме того, следует иметь в виду, что поверхность нагрева обычно покрыта слоем окислов, который выполняет роль цементирующей прослойки между металлом и отложениями, кристаллизующимися из раствора.
К типичным накипеобразователям могут быть отнесены сернокислый кальций, силикат кальция и сложные алюмоферросиликаты.
Образование котельного шлама происходит в результате выделения в толще пересыщенного раствора кальциевых и магниевых солей зародышей твердой фазы, представляющих собой многочисленные центры кристаллизации солей. На этих центрах откладываются последующие молекулы кристаллизующейся соли, причем первые вследствие этого растут, переходя постепенно из субмикроскопических размеров в микроскопические. Ставший таким образом видимым осадок имеет аморфное или скрытое кристаллическое строение; далее частицы сливаются и с течением времени образуют кристаллические или хлопьевидные осадки. Типичными шламообразователями являются силикат магния (серпентин),гидроксилапатит и карбонат кальция (в щелочной среде).
Одни вещества, выделяясь из раствора в виде твердой фазы, кристаллизуются на горячих (нагреваемых снаружи) поверхностях нагрева, другие – на холодных (охлаждаемых снаружи) поверхностях охлаждения, образуя в том и другом случаях прочную и плотную накипь; третьи выпадают в толще воды в виде взвешенных шламовых частиц. Если кристаллизация солей происходит непосредственно на поверхности нагрева или охлаждения, и при этом образуются твердые отложения, то такое явление называют первичным процессом накипеобразования. Вторичный процесс накипеобразования характеризуется тем, что выпавшие вначале в толщине котловой воды взвешенные частицы осаждаются и затем образуют прочно сцепленные с поверхностью нагрева вторичные отложения.
Рассмотрим условия протекания процесса образования накипи при парообразовании, когда концентрации присутствующих в котловой воде ионов постепенно возрастают. В насыщенном растворе трудно растворимого вещества произведение концентрации ионов достигает величины произведения растворимости ПP, характеризующего предел растворимости данного вещества при данной температуре и зависящего исключительно от температуры и химической природы вещества.
Если через КА обозначить трудно растворимую соль, в которой К+ обозначает катион, а А- – анион, то для насыщенного раствора этой соли имеет место следующее равенство:
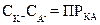 . .
| (4.3) |
Здесь 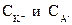 обозначают концентрации соответственно катиона и аниона, выраженные количеством грамм-ионов их в кубическом дециметре (г-ион/дм3)раствора.
обозначают концентрации соответственно катиона и аниона, выраженные количеством грамм-ионов их в кубическом дециметре (г-ион/дм3)раствора.
Произведение растворимости ПP для данного соединения и данной температуры является величиной постоянной; оно изменяется с изменением температуры.
Если 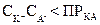 , то раствор не насыщен, и осадок выпадать не будет; при
, то раствор не насыщен, и осадок выпадать не будет; при 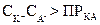 неизбежно выпадение осадка. Для насыщенных растворов сернокислого, углекислого и кремнекислого кальция характерны следующие равенства:
неизбежно выпадение осадка. Для насыщенных растворов сернокислого, углекислого и кремнекислого кальция характерны следующие равенства:
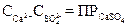 ; ;
| (4.4) |
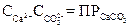 ; ;
| (4.5) |
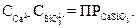
| (4.6) |
Выпадение данной соли из раствора начинается только в том случае, когда произведение концентрации ионов, входящих в ее состав, превышает значение произведения растворимости для данной соли. Из уравнения (4.3) следует, что с увеличением концентрации одного иона концентрация другого иона должна уменьшаться, так как величина произведения растворимости для данной температуры остается без изменений. Если к насыщенному раствору какой-либо соли прибавить электролит с тем же, что и в растворе катионом или анионом, то равновесие раствора переместится в направлении уменьшения растворимости данной соли с выделением избытка ее в твердую фазу. Например, в случае прибавления к насыщенному раствору CaSO4 электролита Na2SO4 или СаС12 равновесие окажется нарушенным в сторону уменьшения растворимости CaSO4; после выделения избыточного количества его в твердую фазу установится новое состояние равновесия при неизменном 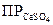 , но с изменением концентраций ионов Са2+ и
, но с изменением концентраций ионов Са2+ и 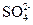 .
.
Дата добавления: 2017-03-12; просмотров: 2938;











