Поляризация электродных процессов
Термодинамические данные о протекании коррозионного процесса не дают сведений о его скорости. В большинстве случаев основным тормозящим фактором, определяющим скорость электрохимической коррозии, является явление поляризации. Поляризация - изменение потенциала электрода в результате протекания тока.
Измерения показывают, что при замыкании электродов обратимого гальванического элемента с потенциалами в разомкнутом состоянии (Еa)o6p и (Ек)o6р и сопротивлением электролита R, установившееся значение силы тока I/, меньше значения, рассчитанного по закону Ома:
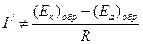 (4.34)
(4.34)
Потенциал анода при прохождении через него тока становится положительнее, а потенциал катода – отрицательнее (рис.4.9).
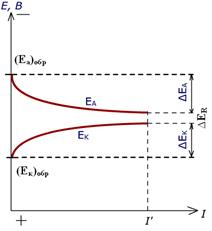
Рис. 4.9. Изменение потенциалов гальванического элемента при прохождении тока.
Поляризация является следствием различных скоростей электродных процессов в коррозионном гальваническом элементе. Анодный процесс выхода ионов металла в раствор ( 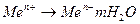 ) отстает от перетока электронов от анода к катоду замкнутой электродной пары (или от анодных к катодным участкам поверхности одного и того же металла), что создает избыток положительного заряда на поверхности анода (анодная поляризация):
) отстает от перетока электронов от анода к катоду замкнутой электродной пары (или от анодных к катодным участкам поверхности одного и того же металла), что создает избыток положительного заряда на поверхности анода (анодная поляризация):
Еа=(Еа)обр + ∆Еа (4.35)
. Катодный процесс ассимиляции электронов (D + nе → [Dne]) отстает от поступления на катод электронов, что вызывает смещение потенциала катода в отрицательную сторону (катодная поляризация):
Ек=(Ек)обр - ∆Ек (4.36)
Кинетику электродных процессов обычно отображают в виде зависимостей потенциала от плотности тока (диаграмм Эванса), получаемых с помощью приборов - потенциостатов. На рис. 4.10 приведены кривые анодной и катодной поляризации металла, характеризующие его поведение в качестве анода и катода коррозионного элемента.
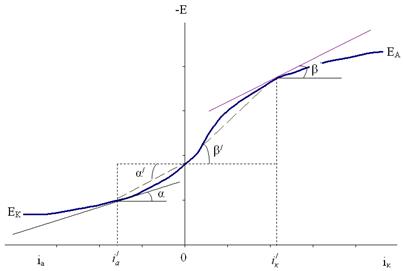
Рис. 4.10. Начальная часть кривых катодной (Ек) и анодной (ЕА) поляризации.
Степень наклона кривых характеризует большую (крутой ход) или малую (пологий ход) замедленность протекания электродного процесса. Количественно это может быть выражено истинной поляризуемостью процесса при данной плотности тока i' в данной точке поляризационной кривой:
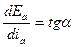 , (4.37)
, (4.37)
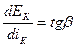 , (4.38)
, (4.38)
или средней поляризуемостью процесса для данного интервала плотности тока на данном участке поляризационной кривой:
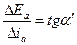 , (4.39)
, (4.39)
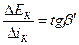 . (4.40)
. (4.40)
Причины анодной поляризации - отставания процесса выхода ионов в электролит от перетока электронов с анодных участков на катодные участки следующие.
1) Поляризация, возникающая вследствие замедленного протекания анодной электрохимической реакции Ме=Меn++ne (4.20), которая определяется соответствующим значением энергии активации этой реакции, называются электрохимической (активационной) поляризацией 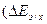 или η) или перенапряжением реакции.
или η) или перенапряжением реакции.
2) Поляризация, вызванная торможением диффузионного подвода или отвода реагирующего вещества. Эту поляризацию, связанную с изменением концентрации реагирующего у поверхности электрода вещества, называют концентрационной поляризацией (ΔЕконц).
При небольших значениях анодной плотности тока (<10-2 А/см2) зависимость перенапряжения ионизации металлов от анодной плотности тока может быть выражена линейным уравнением (участок (ЕМе)обр – А, рис. 4.11, установлено А.С.Савельевым).

а б
Рис. 4.11. Анодные поляризационные кривые в координатах ia – EA (a), и в координатах lgia – EA; (ЕМе)обр АВС – перенапряжение ионизации металла, ВЕ – пассивация металла, 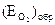 ДЕF – перенапряжение анодного выделения кислорода.
ДЕF – перенапряжение анодного выделения кислорода.
Здесь, при небольших отклонениях электродной реакции от равновесия, электрохимическая поляризация линейно зависит от скорости электродного процесса:
|ΔЕэ/х| = К·i, (4.41)
где К – коэффициент пропорциональности, i – скорость электродного процесса, выраженная в единицах плотности тока.
Для анодной поляризации:
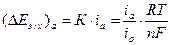 , (4.42)
, (4.42)
где 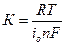 , Ом·см2; i0 – плотность тока обмена, А/см2.
, Ом·см2; i0 – плотность тока обмена, А/см2.
Для катодной поляризации:
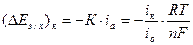 . (4.43)
. (4.43)
При плотностях тока >10-2 А/см2, и, соотвественно, больших отклонениях электродной реакции от равновесия, электрохимическая поляризация может быть представлена логарифмическим уравнением Тафеля:
|ΔЕэ/х| = a + blni, (4.44)
где a – коэффициент, зависящий от природы металла и состояния его поверхности; b – коэффициент, зависящий от механизма возникновения поляризации (перенапряжения).
Для анодной реакции:
(ΔЕэ/х)а = aa +bаlniа, (4.45)
где 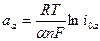 ;
; 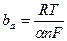 ; α – коэффициент перехода, который обычно принимается равным порядка 0,5; n – число электронов, участвующих в элементарном акте наиболее замедленной стадии реакции; F =96500 кул/г - экв. – число Фарадея; Т – абсолютная температура, К; i0а – плотность тока обмена анодного процесса.
; α – коэффициент перехода, который обычно принимается равным порядка 0,5; n – число электронов, участвующих в элементарном акте наиболее замедленной стадии реакции; F =96500 кул/г - экв. – число Фарадея; Т – абсолютная температура, К; i0а – плотность тока обмена анодного процесса.
Для катодной реакции:
(ΔЕэ/х)к = –(aк +bкlniк), (4.46)
где 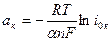 ,
,  – коэффициенты a и b для катодного процесса; i0к – плотность тока обмена катодного процесса.
– коэффициенты a и b для катодного процесса; i0к – плотность тока обмена катодного процесса.
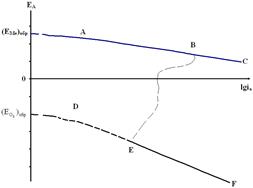
Концентрационная поляризация обусловлена замедленностью диффузии ионов от поверхности металла в объем раствора. Величину концентрационной поляризации электродного процесса можно рассчитать по разнице активностей исходных и конечных реагентов в уравнении Нернста. Для реакции Ме=Меn++ne:
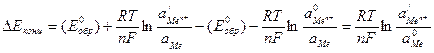 (4.47)
(4.47)
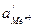 и
и 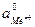 - активности ионов металла у поверхности электрода и в объеме электролита соответственно.
- активности ионов металла у поверхности электрода и в объеме электролита соответственно.
Отсюда для анодного процесса:
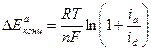 , (4.48)
, (4.48)
где: ia – анодная плотность тока; id – предельная диффузионная плотность тока, определяемая максимальной скоростью отвода участвующих реагентов от поверхности анода.
Для катодного процесса:
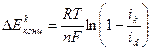 , (4.49)
, (4.49)
где: iк – катодная плотность тока; id – предельная диффузионная плотность тока, определяемая максимальной скоростью подвода участвующих реагентов от поверхности катода.
Большая замедленность анодной реакции ионизации металла происходит при возникновении анодной пассивности. Анодная поляризация металлов в определенных условиях может облегчать переход металлов в пассивное состояние (образование первичных фазовых или адсорбционных защитных пленок), что сопровождается резким торможением анодного процесса с соответствующим падением плотности тока и значительным смещением потенциала электрода в положительную сторону (участок ВЕ, рис.4.11) до значений, достаточных для протекания нового анодного процесса, обычно выделения кислорода, участок EF кривой 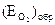 DEF). Значение этой анодной поляризации берут из опытных данных.
DEF). Значение этой анодной поляризации берут из опытных данных.
Суммарно составляющие анодной поляризации можно представить в виде:
ΔΕаΣ=ΔЕэ/х+ΔΕконц+ΔΕпас, (4.50)
где: ΔΕпас – поляризация, обусловленная пассивацией.
Процессы, уменьшающие анодную поляризацию, называются деполяризационными процессами. Вещества, осуществляющие эти процессы, называются анодными деполяризаторами (например, комплексообразователи NH3, CN-) и др. Они сильно понижают активность ионов металлов в растворе вследствие связывания их в труднодиссоциирующие комплексы. Ионы С1- также затрудняют наступление анодной пассивности металлов.
Причинами катодной поляризации - отставания процесса ассимиляции электронов от поступления на катодные участки электронов, являются:
а) замедленность катодной деполяризационной реакции D+nе =[Dne], которая определяется соответствующим значением энергии активации этой реакции, и приводит к возникновению электрохимической поляризации (ΔЕэ/х)к, называемой перенапряжением реакции катодной деполяризации;
б) замедленность диффузии деполяризатора из объема электролита к катодной поверхности или продукта катодной деполяризационной реакции в обратном направлении, которая приводит к концентрационной поляризации катода, 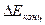 .
.
Суммарно составляющие катодной поляризации можно представить в виде:
ΔΕкΣ=ΔЕэ/х+ΔΕконц. (4.51)
Дата добавления: 2017-02-13; просмотров: 4554;











