Необратимые потенциалы металлов, электроды сравнения
При смещении потенциала металла в положительную сторону относительно равновесного (рис. 4.4, б), анодный процесс осуществляется, в основном ионами металла, а его скорость возрастает 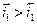 . Скорость катодного процесса, осуществляемого другими ионами (например, водородными) – замедляется
. Скорость катодного процесса, осуществляемого другими ионами (например, водородными) – замедляется 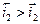 . В результате этого металл начинает растворяться (корродировать) со скоростью i = ia–iк. Установившийся при этом потенциал называется необратимым электродным потенциалом.
. В результате этого металл начинает растворяться (корродировать) со скоростью i = ia–iк. Установившийся при этом потенциал называется необратимым электродным потенциалом.
Необратимый потенциал устанавливается при наличии других ионов в растворе, протекании иных электрохимических реакций, присоединении источника тока и др. В природных условиях и в условиях промышленной эксплуатации обычно протекают побочные катодные электрохимические реакции, которые в результате потребления электронов смещают потенциал металла от обратимого в положительную сторону. Необратимый потенциал не может быть рассчитан по уравнению Нернста, и определяется экспериментально. В эксплуатационных условиях преобладают необратимые потенциалы.
Устойчивое во времени значение необратимого потенциала, соответствующее равенству сумм скоростей анодных и катодных процессов, называется стационарным потенциалом металла. При этом значении потенциала соблюдается равенство:
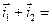
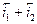 , (4.17)
, (4.17)
но, в отличие от предыдущего случая с установлением обратимого потенциала, ΔmМе≠ 0, т.е. происходит электрохимическое растворение (коррозия) металла, так как  . Отсюда следует, что скорости анодных и катодных процессов сильно влияют на величину стационарных необратимых электродных потенциалов и скорость электрохимической коррозии металлов. Стандартное определение стационарного потенциала - потенциал коррозии - потенциал металла, установившийся в результате протекания сопряженных анодного и катодного процесса без внешней поляризации.
. Отсюда следует, что скорости анодных и катодных процессов сильно влияют на величину стационарных необратимых электродных потенциалов и скорость электрохимической коррозии металлов. Стандартное определение стационарного потенциала - потенциал коррозии - потенциал металла, установившийся в результате протекания сопряженных анодного и катодного процесса без внешней поляризации.
Абсолютные значения электродных потенциалов металлов пока неизвестны. Поэтому значения потенциалов определяют по отношению к электродам сравнения. За нулевой потенциал условно принят стандартный потенциал водородного электрода (с.в.э.), образующийся на поверхности пластины из платинированной платины, омываемую Н2 при давлении 1атм =1,013·105 Па, и погруженную в 1 M раствор HCl. На водородном электроде протекают реакции H2  2Hадс
2Hадс  2H++2e.
2H++2e.
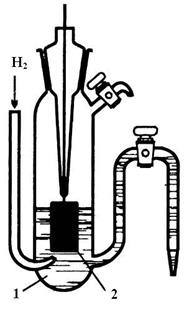
Различные конструкции водородных электродов приведены на рис. 4.5.
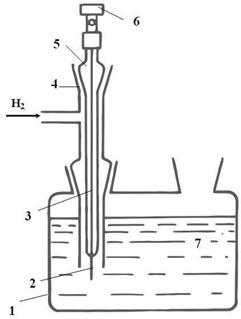
а) б)
Рис. 4.5. Водородные электроды: а) 1- стеклянный сосуд, 2 - платинированная пластина, 3 – платинированная проволока, 4 – стеклянная трубка для пропускания водорода, 5 – стеклянная трубка, 6 – клемма, 7 – раствор кислоты; б) 1- раствор кислоты, 2 – платина.
На практике более удобно использование: 1) хлорсеребряных электродов сравнения, представляющих собой серебряную проволоку, запаянную в пробирку, и помещенную в насыщенный раствор AgCl (Ag + Cl- 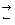 AgCl + e), - для нейтральных растворов; 2) каломельных электродов (2Hg + 2Cl-
AgCl + e), - для нейтральных растворов; 2) каломельных электродов (2Hg + 2Cl- 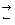 Hg2Cl2 + 2e) – для кислот; 3) окиснортутных (HgO+H2O
Hg2Cl2 + 2e) – для кислот; 3) окиснортутных (HgO+H2O 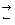 Hg+2OH-) – для щелочей; 4) медносульфатных (Cu2++2e
Hg+2OH-) – для щелочей; 4) медносульфатных (Cu2++2e 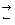 Cu) – для почв; и т.д.
Cu) – для почв; и т.д.
Дата добавления: 2017-02-13; просмотров: 3315;











