Особенности процессов с водородной деполяризацией
Замедленность катодного процесса заметно влияет на скорость коррозии металлов с водородной деполяризацией. Наиболее затрудненными стадиями катодного процесса, в зависимости от условий коррозии, являются разряд водородных ионов и диффузия водорода (диффузионно-кинетический контроль). Относительное значение первой стадии увеличивается с ростом катодной плотности тока (преобладание кинетического контроля).
Характерные особенности коррозии металлов с водородной деполяризацией:
1) меньшая, чем при коррозии с кислородной деполяризацией, зависимость от перемешивания электролита,
3) большая зависимость от рН раствора,
2) большая зависимость от природы и содержания катодных примесей: чем ниже перенапряжение водорода на катодных примесях и чем больше их содержание, тем больше скорость коррозионного процесса,
4) протекание процесса с ускорением (с увеличением скорости коррозии во времени), что обусловлено облегчением протекания катодной реакции разряда водородных ионов в результате увеличения числа микрокатодов на поверхности корродирующего металла за счет обнажения новых катодных участков по мере растворения металла;
5) возможность появления водородной хрупкости металла.
Основные способы борьбы с коррозией металлов в кислотах:
- применение устойчивых металлов и сплавов (платина, меди и бронз), пассивирующихся сталей, нержавеющих хромистых и хромоникелевых сталей, свинца (серная кислота), железа и магниевых сплавов (фтористоводородная кислота); сталей, чистых по катодным примесям;
- использование замедлителей коррозии и ингибиторов;
- нанесение защитных покрытий: металлических (кремний, никель, свинец, плакирование), неметаллических органических (полиэтилен, фторопласт, эпоксидные смолы), неорганических (эмали) и др.;
- электрохимическая защита металлических конструкций анодной поляризацией.
Пример 4.3.Определить электрохимическую поляризацию катода при коррозии цинка с водородной деполяризацией в неподвижном 0,1 m растворе HCI при 298К и катодной плотности тока 50 А/м2, если плотность тока обмена катодной реакции io = 10-6 А/м2, коэффициент перехода α = 1/2. Как изменится величина электрохимической поляризации при перемешивании раствора?
Решение. 1) Электрохимическая поляризация катода (ΔЕэ/х)к = –(aк +bкlniк);
2) ак= 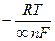 lnio = –
lnio = – 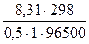 ln10-6=0,709;
ln10-6=0,709;
3) ( 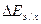 )к = –(0,709 +
)к = –(0,709 + 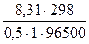 ln50) = –0,909 В
ln50) = –0,909 В
4) При перемешивании раствора тонкий слой электролита вблизи поверхности металла остается неподвижны, поэтому характеристики электрохимической реакции восстановления водорода, в том числе и поляризация при заданной скорости процесса останутся постоянными.
Пример 4.4. Рассчитать ионную (подвод ионов водорода) концентрационную поляризацию катода, считая его макрокатодом, при коррозии цинка по условиям предыдущего примера, если средний коэффициент активности электролита 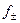 =0,796, эквивалентная электропроводность иона водорода
=0,796, эквивалентная электропроводность иона водорода 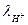 = 325,7 Ом-1см2, а число переноса водородного иона t+ = 0,876. Эффективная толщина диффузионного слоя δd = 0,075 см. Сравнить величины электрохимической и концентрационной поляризаций. Как изменится результат при переходе от макро- к микрокатоду при δd = const.
= 325,7 Ом-1см2, а число переноса водородного иона t+ = 0,876. Эффективная толщина диффузионного слоя δd = 0,075 см. Сравнить величины электрохимической и концентрационной поляризаций. Как изменится результат при переходе от макро- к микрокатоду при δd = const.
Решение. 1) Ионная концентрационная поляризация катода равна:
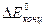 =
= 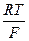 ln
ln 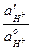 =
= 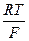 ln (1–
ln (1– 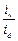 );
);
2) Предельная диффузионная плотность тока: id = 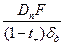 .
. 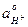 ;
;
3) 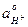 =
= 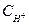 . n .
. n . 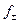 = 0,1 .
= 0,1 . 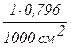 0,796/1000 см3 = 7,96∙10-5 г-ион/см3.
0,796/1000 см3 = 7,96∙10-5 г-ион/см3.
4) Коэффициент диффузии D = 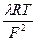 =
= 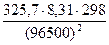
5) Подставляем в выражение для расчета id:
id = 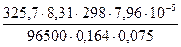 = 54,1 мА/см2 = 541 А/м2.
= 54,1 мА/см2 = 541 А/м2.
6) Находим 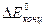 =
= 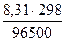 ln (1–
ln (1– 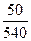 ) = –2,49.10-3 В = –2,49 мВ
) = –2,49.10-3 В = –2,49 мВ
7) Наиболее затрудненной является электрохимическая реакция (ΔEэ/х =–0,909B), в то время как концентрационная поляризация мала (ΔEконц =–2,49 мВ). При переходе от макро- к микрокатоду величина электрохимической поляризации практически не изменится, так как концентрация ионов водорода на поверхности металла остается постоянной, близкой к объемной. Величина концентрационной поляризации (при δd = const ) несколько уменьшится в результате облегчения подвод ионов водорода за счет боковых путей диффузии к катоду.
Дата добавления: 2017-02-13; просмотров: 3039;











