Водородная деполяризация
Процессы коррозии металлов, у которых катодная деполяризация осуществляется водородными ионами, называются коррозией металлов с водородной деполяризацией. Водородная деполяризация - катодная реакция восстановления ионов водорода.
В кислых средах протекает реакция (4.22), в щелочных:
2H2O + 2e = H2 +2OH- (4.63).
С водородной деполяризацией корродирует оборудование, соприкасающиеся с растворами кислот, например стальные железнодорожные цистерны для перевозки кислот, металлические баки и аппараты на химических заводах, травильные отделения прокатных цехов и цехов гальванических покрытий.
Коррозия металлов с водородной деполяризацией возможна при условии:
(ЕMe)обр < (Ен2)обр,(4.64)
где: 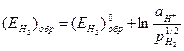 (4.65)
(4.65)
- обратимый потенциал водорода в данных условиях, 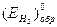 - стандартный потенциал водородного электрода при всех температурах (обратимый потенциал водородного электрода при ан+ = 1 и
- стандартный потенциал водородного электрода при всех температурах (обратимый потенциал водородного электрода при ан+ = 1 и  = 1 атм).
= 1 атм).
В табл. 4.3 приведены значения обратимого потенциала водородного электрода 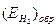 при 25оС и различных значениях рН среды и парциального давления водорода.
при 25оС и различных значениях рН среды и парциального давления водорода.
Таблица 4.3.
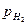 , атм , атм
| рН среды/потенциал | ||
| 5∙10–7 (в атмосфере) | 0,186 | -0,228 -0,414 | -0,641 -0,828 |
Водородная деполяризация протекает с большим торможением и при более отрицательных потенциалах чем кислородная (рис. 4.12, кривая GFH), что обуславливает возникновение перенапряжения выделения водорода, ηH2, в уравнении Тафеля:
ηH2 =-(a3 + b3 ln iк), (4.66)
где константа “b3” не зависит от материала, константа “а3” зависит от природы и состояния поверхности материала катода и численно равна величине перенапряжения при плотности тока, равной единице. В логарифмической шкале кривая перенапряжения будет прямой с константой “b3”, равной тангенсу угла наклона прямой к оси абсцисс, константа “а3” равна величине ординаты lg i = 0 (при плотности тока i = 1).
Перенапряжение водорода зависит от природы металла (рис. 4.16).
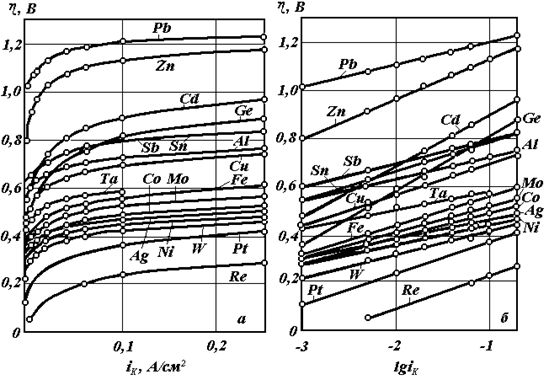
Рис. 4.16. Перенапряжение выделения водорода на технически чистых металлах в 1 М H2SO4 при 25 0С: а – в координатах 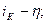 б – в координатах
б – в координатах 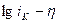 .
.
Катодный процесс выделения водорода состоит из следующих стадий:
1) диффузии и миграции гидратированных ионов H+ к поверхности катода;
2) разряда ионов водорода H+∙H2O + e = Hадс + H2O (4.67)
с образованием адсорбированных атомов водорода;
3) рекомбинации (молизации) атомов водорода Hадс +Hадс = H2 (4.68)
и/или растворения и диффузии части Hадс атомов в металле;
4) образование и отрыв пузырьков H2 от поверхности металла.
В кислых растворах перенапряжение диффузии из-за замедления транспорта H+ к катодным участкам незначительно. Это объясняется высокой поверхностью гидрати-рованных протонов H+∙H2O, а также перемешиванием раствора водородом, выделяющимся на катоде. Основную роль в торможении процесса выделения водорода относят к стадии (4.67) замедленного разряда и стадии (4.68) замедленной рекомбинации.
Согласно теории замедленного разряда, наиболее замедленной стадией катодной реакции, ответственной за перенапряжение, является стадия разряда водородных ионов (4.67). По этой теории коэффициент b3 в уравнении (4.66) равен при 250С:
b3=2,303 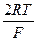 =0,116 , (4.69)
=0,116 , (4.69)
что находится в достаточно хорошем соответствии с опытными данными (рис. 4.16). Теория объясняет также зависимость перенапряжения водорода от pH раствора и строения двойного электрического слоя на катоде.
Теория замедленной рекомбинации (Тафель, 1905) основана на представлении о химической природе торможения реакции (4.68), так как в этой реакции не участвуют электроны. Эта теория также дает логарифмическую зависимость 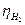 от iк. Однако теория замедленной рекомбинации дает заниженную величину b3.
от iк. Однако теория замедленной рекомбинации дает заниженную величину b3.
Современное понимание природы металла в перенапряжении выделения водорода основано на представлении о способности газов к хемосорбции (“химической” реакции между молекулами и поверхностью твердого вещества). При самопроизвольной хемосорбции H2 на металле возникает выигрыш энергии за счет теплоты образования связи Hадс – Me. В отсутствии хемосорбции водорода затраты энергии на выделение водорода в виде значительного перенапряжения велики. Прочная хемосорбция водорода на переходных металлах (Pt, Pd, Ti, W, Ni, Fe) сильно снижает величину 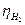 .
.
Поляризацию вследствие замедленной диффузии водородных ионов к катодной поверхности называют ионной концентрационной поляризацией водорода, значение которой:
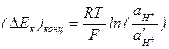 , (4.70)
, (4.70)
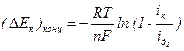 , (4.71)
, (4.71)
где: 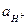 - активность водородных ионов в объеме раствора;
- активность водородных ионов в объеме раствора; 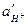 - активность водородных ионов у поверхности катода;
- активность водородных ионов у поверхности катода; 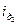 - предельная диффузионная плотность тока по водородным ионам.
- предельная диффузионная плотность тока по водородным ионам.
Поляризация, обусловленная замедленной диффузией молекулярного водорода от катодных участков в глубь раствора, называется газовой концентрационной поляризацией:
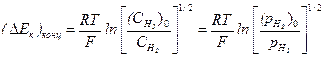 , (4.71, а)
, (4.71, а)
где: 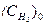 - концентрация молекулярного водорода у катодной поверхности;
- концентрация молекулярного водорода у катодной поверхности; 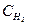 - его концентрация в объеме раствора;
- его концентрация в объеме раствора; 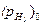 и
и 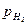 - парциальные давления водорода у катодной поверхности и в атмосфере соответственно.
- парциальные давления водорода у катодной поверхности и в атмосфере соответственно.
В отличие от ионной, газовая концентрационная поляризация постоянно сопровождает процесс водородной деполяризации. К началу выделения пузырьков водорода (парциальное давление водорода в пузырьке: 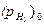 = ратм = 1 атм) в атмосферу воздуха, где парциальное давление водорода составляет
= ратм = 1 атм) в атмосферу воздуха, где парциальное давление водорода составляет 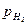 = 5.10-7 атм, её значение составляет 0,186 В, и дальше не меняется.
= 5.10-7 атм, её значение составляет 0,186 В, и дальше не меняется.
Дата добавления: 2017-02-13; просмотров: 7623;











