Термодинамика электрохимической коррозии металлов, диаграммы Пурбэ
Так, же как и для химической коррозии, термодинамическая возможность протекания процесса электрохимической коррозии определяется знаком изменения энергии Гиббса ΔG. При ΔG<0самопроизвольный процесс коррозии возможен, при ΔG>0 – невозможен. При ΔG=0имеет место равновесие, характеризующее отсутствие потерь массы металла:
ΔG = –nFE, (4.18)
где n – число грамм–эквивалентов; E=(Ek)обр–(Ea)обр – ЭДС элемента, в котором обратимо осуществляется данный коррозионный процесс; (Ek)обр, (Ea)обр – обратимые потенциалы катодного и анодного процесса в данном электролите.
Протекание самопроизвольного коррозионного процесса возможно, если: (Ek)обр– (Ea)обр > 0, или:
(Ek)обр > (Ea)обр, (4.19)
т.е. для электрохимического растворения металла необходимо присутствие окислителя, обратимый потенциал которого положительнее обратимого потенциала металла. С увеличением разности потенциалов возрастает ток, и, соответственно, скорость коррозии.
Для установления границ термодинамической возможности протекания электрохимической коррозии металлов используются диаграммами состояния E - pH систем металл - оксид, разработанными Пурбэ (рис.4.6).
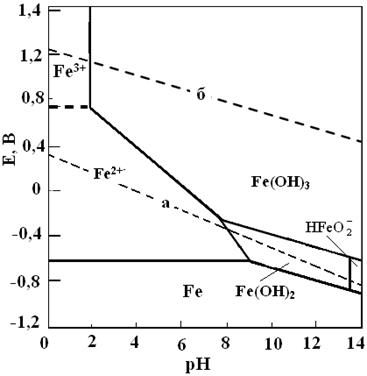
Рис. 4.6. Упрощенная диаграмма E – pH системы Fe – H2O при 250С для гидратированной формы оксидов.
Диаграммы представляют собой графики зависимости обратимых электродных потенциалов от pH раствора для соответствующих равновесных реакций с участием электронов (горизонтальные линии) и электронов и ионов H+ или ОН- (наклонные линии). Вертикальными линиями показаны равновесия с участием ионов H+ или ОН-.
Диаграммы состоят из областей, разграниченных между собой кривыми равновесия. Положение этих кривых зависит от активности водородных и других ионов, участвующих в установлении равновесия в растворе. Различным областям диаграммы соответствует одно термодинамически устойчивое состояние: области, расположенной в нижней части диаграммы системы, соответствует металлическое состояние. При pH и потенциалах, соответствующих этой области, металлическое железо термодинамически устойчиво и не подвержено коррозии. Области в левой части диаграммы, соответствуют термодинамически устойчивые состояния железа в виде иона Fe2+, и в виде иона Fe3+. Металлическое железо, находящееся в условиях, отвечающих какой-либо точке этой области, термодинамически неустойчиво и будет с той или иной скоростью корродировать с образованием соответствующих ионов.
Средняя область диаграммы соответствует твердому гидрату закиси железа Fe(OH)2, а выше - твердому гидрату окиси железа Fe(OH)3. Железо при рН>9 и потенциалах свыше -0,8 В, будет корродировать с образованием защитной пленки Fe(OH)2 или еще более защитной пленки Fe(OH)3, которые тормозят протекание процесса коррозии. Небольшая область в правой части диаграммы, соответствует термодинамически устойчивому состоянию железа в виде аниона HFeO2- в растворе.
Линии а и 6 на диаграмме соответствуют электрохимическим равновесиям воды с продуктами ее восстановления - водородом (а) и окисления - кислородом. Область между этими линиями, является областью устойчивости воды. При при потенциалах, лежащих выше линии б, вода окисляется, а ниже линии а - восстанавливается. При обратимых потенциалах железа, отрицательнее потенциалов, соответствующих линии б (для 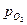 =0,21 атм), термодинамически возможна коррозия с кислородной деполяризацией, а отрицательнее потенциалов, соответствующих линии а (для
=0,21 атм), термодинамически возможна коррозия с кислородной деполяризацией, а отрицательнее потенциалов, соответствующих линии а (для 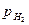 =5-10 атм) - с водородной деполяризацией.
=5-10 атм) - с водородной деполяризацией.
С помощью соответствующей диаграммы Пурбэ можно определить термодинамическую возможность коррозии или анодного растворения металла, термодинамически возможный катодный деполяризационный процесс и ожидаемые продукты коррозии данного металла.
Дата добавления: 2017-02-13; просмотров: 2832;











