Процессы с кислородной деполяризацией
Процессы коррозии металлов, у которых катодная деполяризация осуществляется растворенным в электролите кислородом, называются процессами коррозии металлов с кислородном деполяризацией. Кислородная деполяризация - катодная реакция восстановления (ионизации) кислорода. С кислородной деполяризацией, наиболее распространенным процессом, корродируют металлы, находящиеся в атмосфере (металлическое оборудование различных заводов, различные охладительные системы), обшивка речных и морских судов, различные трубопроводы и др.
Процессы коррозии с кислородной деполяризацией протекают, если соблюдается условие:
(ЕMe)обр < ( 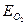 )обр, (4.52)
)обр, (4.52)
где: 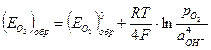 (4.53) - обратимый потенциал кислородного электрода в данных условиях; (
(4.53) - обратимый потенциал кислородного электрода в данных условиях; ( 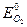 )обр – стандартный потенциал кислородного электрода при 250С (обратимый потенциал кислородного электрода при аOH– = 1 и
)обр – стандартный потенциал кислородного электрода при 250С (обратимый потенциал кислородного электрода при аOH– = 1 и 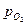 = 1 атм =1,013.105 Па);
= 1 атм =1,013.105 Па); 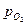 – парциальное давление кислорода; аOH– – активность гидроксил- ионов. В нейтральных и щелочных растворах ионизация молекул O2 протекает по реакции: O2 + 2H2O + 4e = 4OH-.
– парциальное давление кислорода; аOH– – активность гидроксил- ионов. В нейтральных и щелочных растворах ионизация молекул O2 протекает по реакции: O2 + 2H2O + 4e = 4OH-.
Значение обратимого потенциала кислородного электрода 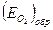 при 25oC для различных значений рН и
при 25oC для различных значений рН и 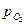 приведены в табл. 4.2.
приведены в табл. 4.2.
Таблица 4.2.
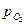 , атм , атм
| рН среды/потенциал | ||
| 0,21 (в атмосфере) | 1,218 1,229 | 0,805 0,815 | 0,391 0,400 |
Схема катодного процесса включает несколько последовательных стадий:
1) растворение кислорода воздуха в электролите;
2) перенос растворенного кислорода их объема электролита к поверхности катода за счет естественной конвекции или его перемешивания;
3) перенос растворенного кислорода за счет диффузии молекул O2 из объема к поверхности катода;
4) ионизация молекул кислорода в нейтральных и щелочных растворах:
O2 + 2H2O + 4e → 4OH-, (4.53)
в кислых растворах по реакции:
O2 + 4H+ + 4e → 2H2O; (4.54)
5) в нейтральных или щелочных растворах - диффузия и конвективный перенос ионов OH- от поверхности катода в объем электролита, или реакция с образованием труднорастворимого гидроксида металла: Men++ nOH- = Me(OH)n.
В большинстве случаев коррозии с кислородной деполяризацией наиболее затрудненные стадии катодного процесса: в спокойных электролитах - диффузия кислорода; при больших скоростях подвода кислорода к корродирующему металлу (сильное перемешивание электролита или тонкая пленка электролита на поверхности металла) - ионизация кислорода. Часто наблюдается соизмеримая заторможенность обеих стадий.
Электрохимическая поляризация вследствие замедленности реакций (4.53 - 4.54), которые при отсутствии поляризации должны протекать при потенциале катода, равном 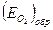 , называется перенапряжением ионизации кислорода. Перенапряжение ионизации кислорода зависит от катодной плотности тока, материала катода, температуры и т.д.
, называется перенапряжением ионизации кислорода. Перенапряжение ионизации кислорода зависит от катодной плотности тока, материала катода, температуры и т.д.
При малых плотностях катодного тока (< 10-2 А/м2) перенапряжение ионизации кислорода прямо пропорционально зависит от плотности тока (участок 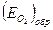 А на рис. 4.12):
А на рис. 4.12):
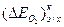 = k2 . ik, (4.55)
= k2 . ik, (4.55)
где ik – постоянная, зависящая от материала и состояния поверхности катода, температуры, и т.д.
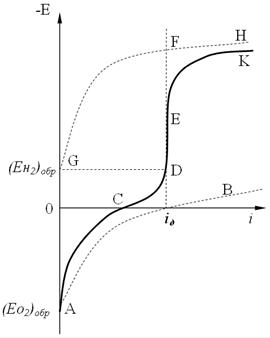
Рис. 4.12. Катодная поляризационная кривая: 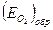 АВ - перенапряжение ионизации кислорода;
АВ - перенапряжение ионизации кислорода; 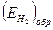 GH - перенапряжение водорода;
GH - перенапряжение водорода; 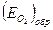 CDEK - общая кривая катодной поляризации.
CDEK - общая кривая катодной поляризации.
При больших плотностях тока (>10–2 А/м2) и значительной скорости подвода кислорода к катоду перенапряжение ионизации кислорода имеет логарифмическую зависимость от плотности тока:
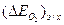 = a2 + b2 lnik, (4.56)
= a2 + b2 lnik, (4.56)
где: a2 - константа, зависящая от материала катода и состояния его поверхности, температуры и других факторов. Она равна 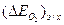 при iк = 1; b2 - константа, обусловленная механизмом перенапряжения ионизации кислорода, равная 2RT/nF ∙ 2,303. При 200С и n= 1, b2 = 0,117.
при iк = 1; b2 - константа, обусловленная механизмом перенапряжения ионизации кислорода, равная 2RT/nF ∙ 2,303. При 200С и n= 1, b2 = 0,117.
Поляризацию вследствие замедленности диффузии кислорода к катодной поверхности называют концентрационной, 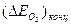 ; значение этой поляризации можно вычислить по уравнению:
; значение этой поляризации можно вычислить по уравнению: 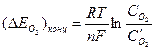 , (4.57)
, (4.57)
где: n - число электронов, участвующих в катодном процессе ионизации одной молекулы кислорода; 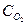 - концентрация кислорода в объеме раствора;
- концентрация кислорода в объеме раствора; 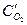 - концентрация кислорода у поверхности катода.
- концентрация кислорода у поверхности катода.
Оценка поляризации по концентрации также дает уравнение (4.49), с учетом которого суммарная величина катодной кислородной поляризации:
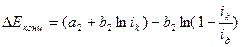 , (4.58)
, (4.58)
где: iд – предельная диффузионная плотность тока, определяемая по экспериментально полученным катодным поляризационным кривым (рис. 4.12), или расчетным методом.
При коррозии металлов в электролитах в большинстве случаев некоторые участки поверхности металла растворяются (аноды), на других протекает катодный процесс (катоды) – гетерогенный механизм коррозии. Такое разделение поверхности обусловлено неоднородностью поверхности металла (наличие зерен с различной ориентировкой, границ зерен, фаз с различной структурой и составом, скоплений дислокаций, включений и т.п.).
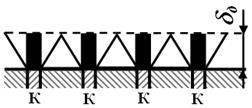
При диффузии кислорода к катоду (в общем случае, подводу – отводу реагирующих веществ к поверхности металла) Н.Д. Томашовым показано, что при расчете количества диффундирующего к отдельному катоду кислорода (рис. 4.13), следует учитывать как прямые, так и боковые пути диффузии кислорода. Это обусловлено тем, что в диффузионном процессе принимает участие не только электролит в объеме цилиндра BCDE, но и остальной объем электролита. Этот объем в первом приближении эквивалентен объему усеченного конуса FGDE (рис. 4.13). Упрощенно катод принят круглым,
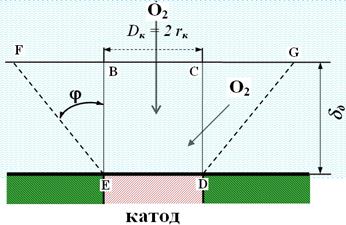
Рис. 4.13. Схема диффузии кислорода к круглому катоду.
с радиусом rk. Тогда, на основании закона Фика, для максимальной диффузионной плотности тока по кислороду справедливо уравнение:
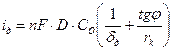 , (4.59)
, (4.59)
где: 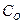 - концентрация кислорода в объеме раствора; D – коэффициент диффузии; δд – толщина диффузионного слоя; φ = 51050/ - угол между образующей конуса диффузии и перпендикуляром.
- концентрация кислорода в объеме раствора; D – коэффициент диффузии; δд – толщина диффузионного слоя; φ = 51050/ - угол между образующей конуса диффузии и перпендикуляром.
Если размеры катода радиуса rк по сравнению с толщиной диффузионного слоя δд достаточно велики (макрокатоды, рис.4.14, а), второе слагаемое в уравнении (4.59) невелико, и им можно пренебречь:
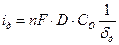 , (4.60)
, (4.60)
при микрокатодах (рис. 4.14,б), можно пренебречь первым слагаемым:
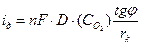 . (4.61)
. (4.61)
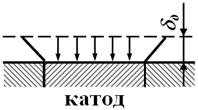
а б
Рис. 4.14. Схема диффузии к макро- (а) и микрокатодам (б).
Что можно рассмотреть в качестве макрокатода, или микрокатода, зависит от допустимой ошибки при приближенном расчете. При ошибке не более 10 % и толщине диффузионного слоя δд = 0,1 см (в спокойном электролите), можно принять размеры: для макрокатодов dk=2rk≥2 см (dk – диаметр катода), для микрокатодов dk≤0,03 см.
Движение жидкости облегчает транспорт вещества. Из теории конвективной диффузии толщину диффузионного слоя можно оценить как:
δд=D1/3v1/6 х1/2 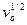 , (4.62)
, (4.62)
где v - кинематическая вязкость жидкости, х – расстояние рассматриваемой точки поверхности электрода относительно точки набегания струи жидкости, vо - скорость движения струи относительно электрода.
Из уравнения (4.62) следует, что толщина диффузионного слоя непостоянна на всей поверхности неподвижного электрода и, следовательно, плотность предельного диффузионного тока зависит oт размеров и формы такого электрода и меняется от одного участка его поверхности к другому.
Для коррозии с кислородной деполяризацией в нейтральных электролитах наиболее характерно:
1) образование на поверхности металлов пленок или рыхлых осадков вторичных труднорастворимых гидроксидов металлов;
2) диффузионный контроль протекания катодного процесса (при плотностях близких к предельной) обеспечивает сравнительно низкие скорости коррозии (относительно кислот):
- в спокойных (неперемешиваемых) электролитах,
- при подземной коррозии,
- при наличии на поверхности металла труднорастворимых продуктов коррозии;
3) при диффузионном контроле катодного процесса присутствие примесей или структурных составляющих в виде микрокатодов мало влияет на скорость коррозии, благодаря использованию боковых путей диффузии O2;
4) кинетический контроль катодного процесса является определяющим при:
- сильном перемешивании электролита (скорость коррозии металла возрастает),
- атмосферной коррозии под тонкой пленкой влаги.
При диффузионно-кинетическом контроле катодного процесса, влияние на скорость катодного процесса перенапряжения ионизации и замедленности диффузии кислорода соизмеримо. Это - наиболее общий случай коррозии металлов с кислородной деполяризацией. В этом случае скорость коррозии так же чувствительна к изменениям условий диффузии кислорода. Вместе с тем скорость процесса зависит от природы и содержания катодных примесей, но в меньшей степени, чем при чисто кинетическом контроле процесса.
При неравномерном доступе кислорода к поверхности железа возникает гальванический элемент дифференциальной аэрации - аэрационный элемент (коррозионный элемент с электродами из одного и того же металла, возникающий за счёт большего притока кислорода к одной из частей поверхности металла).
Из формулы (4.53) следует, что участок с более высокой концентрацией О2 будет иметь больший потенциал, и работать в качестве катода, с меньшей концентрацией – в качестве анода. Это достаточно большая разность потенциалов, и может вызвать значительную скорость коррозии на анодах. Примерами аэрационных элементов является коррозия стальной трубы в почве с различной проницаемостью О2 (песок - глина) (рис. 4.15), или коррозия стальных конструкций по ватерлинии.
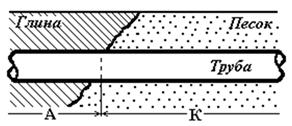
Рис. 4.15. Возникновение аэрационной гальванической пары при прохождении стальной трубы через участки грунта с различной проницаемостью для воздуха.
Дата добавления: 2017-02-13; просмотров: 6701;











