Газовая коррозия железа, стали и чугуна
Железо, чугун, углеродистые и низколегированные стали при нагреве окисляются, особенно при температурах свыше 600°С. Продукт газовой коррозии называется окалиной.
Окалина на железе, чугуне и сталях, образовавшаяся на воздухе при температурах >5750C состоит из слоев оксидов FeO, Fe2O3, Fe3O4, строение которой определяется диаграммой состояния Fe – O (рис. 2.13). Близлежащим к металлу слоем является закись железа FeО (вюстит) с г.ц.к. решеткой, содержащей в элементарной ячейке по четыре иона Fe2+ и О2-. Вюстит устойчив при температурах свыше 575°С, а при медленном охлаждении окалины с высоких температур распадается: 4FeO → Fe3O4 + Fe. Кислорода в вюстите обычно больше стехиометрического состава, и избыточный растворенный О2 отбирает электроны у части катионов Fe2+, окисляя их до Fe3+. Образующиеся анионы О2- занимают анионные узлы решетки, а часть катионных узлов оказывается незанятой с образованием вакансий. Образовавшиеся вакантные катионные места и эквивалентное количество электронных дефектов в виде ионов Fe3+ (движение дефектов Fe2+→Fe3+→Fe2+), обеспечивают хорошую ионную и электронную проводимость вюстита. Cлои оксида FeO из-за высокой дефектности имеют низкие защитные свойства.
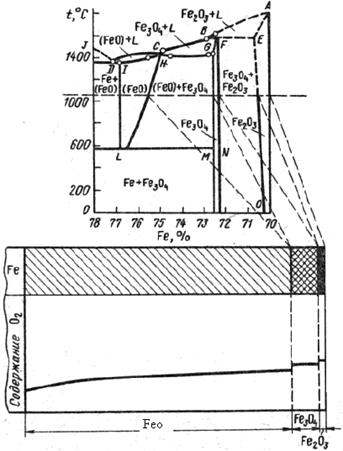
Рис.2.13. Диаграмма состояния Fe-O и схема слоев окалины на железе.
Средний слой окалины, закись-окись железа Fe3О4 (магнетит), стоек при температурах до tпл.=15380С, обладает ферромагнитными свойствами (немагнитен при >500oC), и имеет кристаллографическую решетку типа шпинели (М1М2)2О4, содержащую 8 ионов Fe2+, 16 ионов Fe3+ и 32 иона О2-. Чередование ионов Fe2+ и Fe3+ облегчает передвижение электронов и, соответственно, высокую электронную р - проводимость. Характерная для шпинелей низкая ионная проводимость обуславливает невысокую диффузионную подвижность и существенно более высокие защитные свойства Fe3O4, имеющей структуру шпинели. (Окисление низколегированных сталей и чугуна на воздухе или в перегретом паре при низких температурах приводит к образованию плотной пленки оксидов, преимущественно состоящих из Fe3O4, используется как способ получения покрытий - воронение – используемый для защиты от электрохимической коррозии).
Внешний слой окалины состоит из окиси железа, α–Fe2O3 (гематит), имеет ромбическую кристаллографическую решетку типа корунда с 4 ионами Fe3+ и 6 ионами О2-, и является оксидом с n-проводимостью, рост которого наружу происходит вследствие передвижения анионов кислорода внутрь по вакантным анионным местам. При температуре свыше 11000С диссоциирует.
Окисление Fe и сплавов при нагреве на воздухе происходит в несколько стадий:
1) при t≤ 200oC по логарифмическому закону происходит рост пленки γ-Fe2O3 (псевдоморфная переходная от Fe3O4 к α–Fe2O3 структура);
2) при 200 – 4000С происходит переход γ-Fe2O3→ α–Fe2O3, сопровождающийся утолщением оксидной пленки;
3) при 400 - 4750С под слоем α–Fe2O3 начинается рост Fe3O4;
4) свыше 5750С образуются три слоя: FeO, Fe3O4, α–Fe2O3 и окисление ускоряется по параболической зависимости.
Зависимость изменения скорости окисления от температуры дает изменения наклона семейства прямых в координатах lgK=f lg(1/Т), (рис. 2,10,б), в соответствии с изменениями в металле (эвтектоидное, магнитное и аллотропическое превращения) и прилегающем слое окалины. С учетом этого законы окисления приведены в табл. 2.3.
Таблица 2.3
Схема процесса образования окалины
| Интервал температур | Стадии процесса в окалине и металле | Закон окисления |
| от комнатной до 200°С | образование пленки γ-Fe2О3 | логарифмический |
| от 200 до 400°С | образование наружного слоя α-Fe2О3 на внешней стороне окалины | - “- |
| от 400 до 575°С | образование подслоя Fе3О4 на внутренней стороне окалины | степенной, n > 2 |
| от 575 до 730°С | образование подслоя FeO на внутренней стороне окалины | -“- |
| от 730 до 780°С | магнитное (α-Fe → β-Fe) и эвтектоидное (перлит → аустенит) превращения в стали | параболический |
| от 850 до 900°С | Аллотропическое превращение в стали (β-Fe → γ -Fe) | -“- |
| выше 1100°С | Частичная диссоциация Fe2О3 | Квадратное уравнение |
Дата добавления: 2017-02-13; просмотров: 3655;











