Жаростойкое легирование
Наиболее общим и эффективным методом повышения устойчивости к газовой коррозии является жаростойкое легирование. Существуют 3 наиболее обоснованные теории жаростойкого легирования в зависимости от механизма действия легирующих элементов.
1. Теория уменьшения дефектности оксида основного металла (Вагнер, Хауффе и др.), основана на диффузионной модели окисления, где скорости диффузии и передвижения ионов зависят от уровня дефектности кристаллической решетки оксидной пленки. Поскольку скорость окисления при диффузионном контроле процесса определяется скоростью диффузии ионов металла и окислителя, зависящей от концентрации точечных дефектов, то уменьшение дефектности оксидной пленки снижает скорость окисления.
Дефектами ионной решетки оксида являются: 1) - междоузельные катионы и избыточные электроны (в оксидах с избытком металла), 2) - свободные катионные и электронные вакансии (оксиды с недостатком металла). Изменение концентрации дефектов в решетке оксидов может быть вызвано только введением ионов другой валентности.
1) В оксидах с избытком металла (n – полупроводники) повышение жаростойкости достигается, если n*>n, где n* и n - валентности ионов легирующего и основного элемента. В этом случае замена части катионных узлов на катионы высшей валентности понизит концентрацию точечных дефектов и, соответственно, уменьшит скорость окисления. Например, при легировании цинка алюминием в оксиде ZnO три иона Zn2+ в узлах решетки оксида заменяются двумя ионами Al3+ для сохранения электронейтральности. Два иона Al3+ займут места двух ионов Zn2+, а место третьего иона Zn2+ займет тот же ион из междоузельного пространства. Это уменьшит концентрацию междоузельных катионов и приведет к снижению скорости диффузии катионов и, соответственно, контролируемой ей скорости окисления сплава. Чем больше избыток металла в оксиде, тем больше должна быть добавка металла большей валентности для уменьшения скорости окисления основного металла.
Легирование небольшой добавкой металла, образующего ионы низшей валентности, (например Li+), повысит скорость окисления основного металла.
Так легирование Zn 1,0% Аl уменьшает константу скорости окисления этого сплава при 390°С в 800 раз, а добавление 0,4% Li увеличивает скорость окисления на 4.103.
2) В полупроводниковых оксидах р – типа с недостатком металла (или избытком кислорода) повышение жаростойкости обеспечивается при n*<n. Для оксидов этого типа (NiO, FeO, Cu2O) - наоборот, легирование решетки ионов низшей валентности уменьшит концентрацию ионных вакансий и скорость окисления будет снижаться. Так, при легировании никеля литием в NiO один ионNi2+ в узлах решетки оксида заменяется двумя ионамиLi+. Из двух ионов Li+ только один может занять место Ni2+, а другой занимает вакансию. Число катионных вакансий уменьшится, снизится скорость диффузии катионов сквозь оксидную пленку, и, соответственно, уменьшится скорость окисления.
Введение небольшой добавки металла, образующего ионы высшей валентности, чем основной металл, повышает его скорость окисления.
При легировании металла той же валентности n*=n, должно соблюдаться условие r*i < ri, где ri – радиусы ионов. Замена в оксиде катионов основного металла катионами добавки той же валентности уменьшает концентрацию катионных дефектов, и, соответственно, скорость окисления, если радиус легирующего иона меньше радиуса иона основного металла.
Кроме этого, оксид легирующего элемента (M*) должен иметь большее сродство к кислороду: 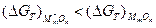 и хорошую растворимости своего оксида М*mОn в оксиде основного металла МmОn.
и хорошую растворимости своего оксида М*mОn в оксиде основного металла МmОn.
Данная теория позволяет прогнозировать влияние низкого легирования на жаростойкость основного металла. Если диффузия ионов не является контролирующей стадией окисления металлов, а определяется другими процессами, легирование приводит к образованию в оксидной пленке новой фазы, данная теория неприменима.
2. Теория образования высокозащитного оксида легирующего элемента (А.А. Смирнов, Н. Д. Томашов и др.) связывает механизм повышения жаростойкости с образованием на поверхности сплава более защитного оксида легирующего элемента, который затрудняет диффузию и окисление основного металла. По этой теории легирующий компонент (M*) должен: 1) удовлетворять условию сплошности 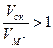 ; 2) образовывать оксид с наименьшей ионной и электронной электропроводностью; 3) иметь r*i < ri; 4) обладать большей энергией образования оксида, чем основной металл (легирующий оксид должен быть термодинамически менее стоек, чем основной); 5) иметь высокие температуры плавления и возгонки легирующего оксида и не образовывать низкоплавких эвтектик с другими оксидами; 6) обладать температурной стойкостью, т.е. иметь высокие значения равновесного давления (упругости диссоциации) оксида и температуры сублимации; 7) образовывать твердый раствор с основным металлом при данном проценте легирования.
; 2) образовывать оксид с наименьшей ионной и электронной электропроводностью; 3) иметь r*i < ri; 4) обладать большей энергией образования оксида, чем основной металл (легирующий оксид должен быть термодинамически менее стоек, чем основной); 5) иметь высокие температуры плавления и возгонки легирующего оксида и не образовывать низкоплавких эвтектик с другими оксидами; 6) обладать температурной стойкостью, т.е. иметь высокие значения равновесного давления (упругости диссоциации) оксида и температуры сублимации; 7) образовывать твердый раствор с основным металлом при данном проценте легирования.
Данная теория жаростойкого легирования подтверждается образованием защитного оксида Аl2О3 на Fe, легированном 8 - 10% А1; ZnO на Сu , содержащей > 20%Zn; А12O3 на Сu при легировании >3% А1; ВеО на Сu, легированной >1% Be, и др.
Теория позволяет на основе свойств элементов и их оксидов, качественно оценить пригодность различных элементов для среднего и высокого жаростойкого легирования.
3. Теория образования высокозащитных двойных оксидов связывает повышение жаростойкости при легировании образованием смешанных двойных оксидов основного и легирующего компонента, защитные свойства которых выше оксида любого компонента. Это оксиды с кристаллической решеткой типа шпинели и составом M1М*2O4, обладающие более высокими защитными свойствами по сравнению с оксидами компонентов сплава.
Повышение жаростойкости железных сплавов по этой теории обеспечивается: 1) снижением возможности образования наименее защитного вюстита (FeO, c г.ц.к.), что определяется диаграммой состояния, 2) преимущественным образованием оксидов типа шпинели с меньшими параметрами кристаллической решетки в окалине.
Низкое легирование Al, Cr, Si, повышая температуру появления вюстита в окалине, уменьшает возможность образования вюститной фазы, и благоприятствует образованию шпинелей с малым параметром решетки (FeAl2О4, FeCr2O4, NiFe2O4, NiCr2O4 и др.), что повышает жаростойкость железных сплавов.
Теория позволяет прогнозировать влияние легирования на жаростойкость сталей.
Рассмотренные теории жаростойкого легирования дополняют друг друга и позволяют дать теоретическое обоснование существующих жаростойких сплавов, и более рационально подойти к разработке рецептуры новых жаростойких сплавов.
3.1.1. ЖАРОСТОЙКИЕ СПЛАВЫ
По характеру поведения при повышенных температурах металлы можно разделить на пять групп: 1) щелочные и щелочноземельные с V0K/VM < 1, окисление которых происходит по линейному закону. При повышении температуры реакция окисления таких металлов может ускоряться, и, поскольку тепло экзотермической реакции окисления не успевает отводиться от поверхности, наступает возгорание металла. По возрастанию скорости окисления на воздухе эти металлы располагаются: К> Na>Li>Ва>Са>Mg;
2) основные практически используемые металлы, окисление которых происходит преимущественно по параболической зависимости, но может сопровождаться уменьшением степени n < 2 (например, при растрескивании окалины, или повышенных температурах, где иногда наблюдается переход к линейному закону окисления). При низких температурах металлы окисляются по кубическому или логарифмическому закону. По жаростойкости их условно можно расположить в последовательности Мn < Fe < Ti < Со< Zr<Cu< Ni;
3) неблагородные металлы, наиболее жаростойкие, из-за образования оксидных пленок с высокими защитными свойствами, вследствие чего их используют в качестве легирующих компонентов жаростойких сплавов и для жаростойких покрытий. Жаростойкость возрастает в ряду: Zn < Si < Be < Al < Cr;
4) металлы c летучими оксидами при повышенных температурах, скорость окисления которых определяется скоростью сублимации их оксидов. При достаточно высоких температурах образующиеся оксиды полностью теряют защитные свойства, и скорость окисления металлов определяется линейной зависимостью. Возрастание стойкости к окислению этих металлов происходит в ряду Mo< W <V <Re <Os <Ru <Ir. Несмотря на недостаточную жаростойкость этих металлов при высоких температурах Mo, W, Re, и их сплавы, имеют высокую температуру плавления и жаропрочность, почему их используют в качестве электронагревательных элементов печей, ламп накаливания, для сопел и лопаток реактивных двигателей. Вследствие низкой жаростойкости эти металлы используются с защитными покрытиями, или же в неокислительных и инертных средах, вакууме;
5) термодинамически стабильные благородные металлы, т.к. их оксиды неустойчивы и имеют высокое равновесное давление (упругость диссоциации оксида). Возрастание термодинамической стабильности происходит в ряду: Au>Pt>Ir>Pd>Ag.
Легирование является наиболее эффективным методом повышения жаростойкости. Кроме того, к современным жаростойким материалам предъявляются требования по жаропрочности, длительной прочности, усталости при знакопеременных нагрузках, и т.д. Основными жаростойкими и жаропрочными материалами являются сплавы на основе Fe и Ni. Наиболее эффективно повышают жаропрочность элементы: Cr> Al> Si (рис.2.14), образующие защитные оксидные пленки Cr2O3, Al2O3, SiO2. С увеличением концентрации легирующих элементов и при совместном легировании Cr, Al, Si возрастает жаростойкость сталей (рис. 3.2).
В качестве основных жаростойких материалов применяются легированные теплоустойчивые стали (группа II – III, до 9% Сr), длительно работающие в нагруженном состоянии до 6000С и различные высоколегированные жаростойкие стали и сплавы, основным легирующим компонентом в которых является хром.
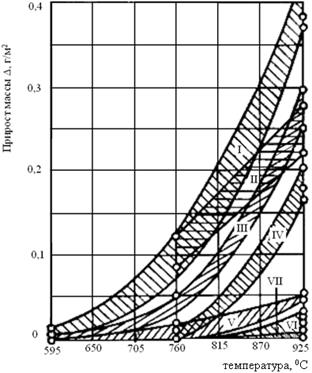
Рис.3.2. Жаростойкость различных групп сталей: I – углеродистые, II – низколегированные, III – среднелегированные с 6% Cr, IV – высоколегированные хромистые (12 – 17% Сr), V – высоколегированные с кремнием (сильхром c 8-12% Cr, 2-3 % Si); VI – хромоникелевые аустенитные (Х18Н10), VII – высокохромистые (25-30 %Cr), воздух, 250 ч.
Дополнительное легирование Ni повышает жаропрочность сталей. Для жаропрочных сплавов на никелевой основе жаростойкость обеспечивается легированием Сr. Легирование Mo, W, Co, а также Ta, Nb ухудшает жаростойкость, но повышает жаропрочность сплавов (рис. 3.3).
Рис. 3.3. Влияние содержания легирующих элементов на относительную скорость окисления (Кспл/КМ) никеля при 600-14000С.
Основные жаростойкие и жаропрочные материалы приведены в таблице 3.1.
Таблица 3.1.
Некоторые жаростойкие и жаропрочные материалы.
| Название/ марка | Состав, % | Температура эксплуатации, (мах) 0С | Применение | Структура сплава | ||||
| По жаростойкости | по жаропрочности | |||||||
| Углеродистые стали | ||||||||
| БСт1-БСт3 и др. | Fe(0,1-0,3)С | Листы котельных топок | феррит | |||||
| Теплоустойчивые стали | ||||||||
| 12МХ | Трубы пароперегревателей, паропроводы | перлит | ||||||
| 12Х1МФ | То же | То же | ||||||
| 18Х3МВ | Трубы гидрогенизационных установок | То же | ||||||
| 15Х5 | Трубы, подвески котлов | мартенсит | ||||||
| 15Х5М | Корпуса аппаратуры нефтеперерабатывающих заводов | То же | ||||||
| 12Х8ВФ | Трубы печей и коммуникаций | То же | ||||||
| Высоколегированные стали и сплавы | ||||||||
| 40Х9С2 | Клапаны автомобильных моторов | мартенсит | ||||||
| 40Х10С2М | То же | То же | ||||||
| 12Х13 | Детали турбин, котлов | мартенсит-феррит | ||||||
| 08Х17Т | То же | феррит | ||||||
| 15Х25Т | Детали термопар, теплообменники | То же | ||||||
| 15Х28 | То же | То же | ||||||
| 08Х20Н14С2 | Трубы | аустенит-феррит | ||||||
| 12Х18Н9Т | Трубы, печная арматура, муфели | аустенит | ||||||
| 12Х18Н12Т | То же | аустенит | ||||||
| 36Х18Н25С2 | Клапаны моторов | То же | ||||||
| 55Х20Г9АН4 | То же | То же | ||||||
| 20Х23Н18 | Установки конверсии метана, пиролиза | То же | ||||||
| 12Х25Н16Г7АР | Газопроводные системы | То же | ||||||
| Сплавы на железоникелевой основе | ||||||||
| Х15Н60 (нихром) | Проволока, ленты нагревателей | |||||||
| ХН38ВТ | Детали газовых систем, турбин | |||||||
| ХН45Ю | Детали печей обжига, турбин | |||||||
| Сплавы на никелевой основе | ||||||||
| ХН60Ю | Детали газовых систем, турбин | |||||||
| ХН70Ю | То же | |||||||
| ХН78Т | То же + трубы | |||||||
| ХН75МБТЮ | То же | |||||||
| ХН80ТБЮ | Лопатки турбин, крепеж | |||||||
| Кобальтовые сплавы | ||||||||
| Виталиум | Co30Cr3Ni5Mo1 | Лопатки турбин | Аустентная | |||||
| Co23Cr6Ni6Mo2Ta | То же | То же | ||||||
| Чугуны | ||||||||
| СЧ 15-32 | Fe2Si3C | Неответственные детали | Феррито-графитная | |||||
| Нирезист | Fe3Cr14Ni2Si2C6Cu2Mn | Повышенные нагрузки | Аустенито-графитная | |||||
| СЧ 21- 40 | Fe8Si2C | Печная арматура | Феррито-графитная | |||||
| Х34 | Fe34Cr2Si2C | То же с повышенными нагрузками | Феррито-карбидная | |||||
Примечание. Выделены материалы, используемые преимущественно в качестве жаропрочных с длительным режимом работы (50000 – 100000 ч).
В качестве других мер повышения жаростойкости используется изменение структуры материала. Так, для теплоустойчивых Cr-Mo сталей типа 12ХМ, 12Х1МФ – это стабилизация карбидной фазы и упрочняющая термообработка на более жаростойкую бейнитную структуру. Для аустенитных сталей типа Х18Н10, содержащих 5 – 15 % феррита, используют аустенизацию, поскольку аустенитная структура более жаростойка, и т.д.
Защитные покрытия
Для защиты от химической коррозии применяют защитные металлические и неметаллические покрытия. Использование защитных покрытий для жаростойкого оборудования менее долговечно, чем легирование, но более экономично. Покрытия подразделяются по материалу покрытия - на металлические и неметаллические, и по способу получения покрытий. Защитные покрытия должны иметь хороший защитные свойства и адгезию к основному металлу, наименьшую пористость.
МЕТАЛЛИЧЕСКИЕ ПОКРЫТИЯ.
Для защиты от газовой коррозии в качестве основных металлических материалов, применяемых для покрытий углеродистых и легированных сталей, используют алюминий, хром и кремний, которые наносят на поверхность изделий различными методами.
Плакирование осуществляется горячей прокаткой или сваркой взрывом более высоколегированного материала на основной покрываемый материал. Так из углеродистых или низколегированных сталей получают биметалл с высокохромистыми или хромоникелевыми жаростойкими сталями (Х25, Х18Н10, Х17Н13М2Т, Х23Н18, 0Х23Н28МЗДЗТ и др.). Медь плакируют нихромом или инконелем (80%Ni, 14%Сr, 6% Fe). Производство жаростойких биметаллов позволяет экономить около 60 - 70% высоколегированных сталей и дорогих легирующих элементов.
Наплавкаосуществляется различными методами сварки: газопламенной, дуговой, индукционной, плазменной, под флюсом, в защитных газах и др. Позволяет получить на основном металле беспористые защитные покрытия наплавленного металла практически любой толщины и химического состава. Наплавку часто применяют восстановления изношенных изделий, для изготовления клапанов двигателей внутреннего сгорания и аналогичных деталей.
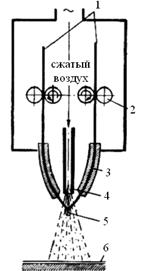
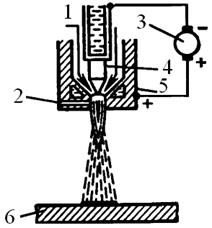
Металлизация распылением – процесс получение покрытий распылением расплавленного металла сжатым воздухом или инертным газом. По типу тепловой энергии, используемой для нагрева напыляемого металла, напыление подразделяется на газопламенное, где нагрев осуществляется при сгорании газа (воздух или кислород + ацетилен, пропан, бутан, водород) и электрическое, осуществляемое электрической дугой или плазмой. Газопламенной металлизацией обычно наносят Al (алюминирование), Cu, нержавеющие стали и оксиды Al, Si, Cr. Схема газопламенного напыления приведена на рис. 3. 4, а. Напыляемый металл в виде проволоки, прутка или порошка подается в отверстие 3 и расплавляется горючим газом 2, подающимся в сопло; расплавленный металл выдувается сжатым воздухом 1, образуя струю напыляемого металла 4, расплавленные частицы которого образуют покрытие 5.
а б
Рис. 3.4. Схема газопламенного напыления (а) и характерная структура покрытия (б).
Для покрытий, полученных металлизацией, характерна пористая структура, рис.3.4,б. При движении в высокотемпературной газовой среде частицы напыляемого металла находятся в расплавленном состоянии (2) и покрываются оксидной пленкой (1). При столкновении с покрываемой поверхностью (9), часть которой оплавляется (8), частицы расплющиваются (3), и образуют под действием выдуваемого газа механически сцепленный тонкий слой (4). Поскольку скорость охлаждения частиц велика (104 – 108 град/с), кристаллизация частиц происходит очень быстро и соединение их происходит за счет механического сцепления с выступами подложки и в местах разрушения её оксидной пленки. В последнем случае происходит сплавление металлических частиц с образованием локальных участков сплавления (5) с высокой прочности сцепления. В процессе “налипания” частицы покрывают нерасплавленные частицы (6), между которыми находятся заполненные газом зазоры и пустоты, которые и образуют поры (7). Степень пористости зависит от вида металлизации и технологических параметров (скорость газа, температура и т.д.). Несколько меньше пористость в покрытиях, полученных дуговым и плазменным методами (рис.3.5), однако полностью устранена она может быть только поверхностным оплавлением, прокаткой, высокотемпературным отжигом, пропиткой в жидких металлах, силикатах, жидким стеклом с последующим отжигом, и т.д.). Другим недостатком покрытий является низкая адгезия к основному металлу.
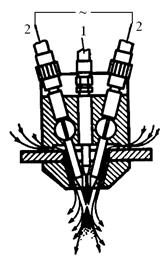
а б в
Рис.3.5. Схема процесса электродуговой металлизации (а): 1- напыляемая проволока, 2 – механизм подачи проволоки, 3 – наконечники, 4 – сопло, 5 – электрическая дуга, 6 – поверхность металлизируемой детали; б - электрометаллизатор: 1 – подача сжатого воздуха, 2 – проволока; в – схема плазменной металлизации: 1- плазмообразующий газ, 2 – напыляемый материал, 3 – источник питания, 4 – катод, 5 – анод, 6 – поверхность изделия.
Дуговые и, особенно, плазменные металлизационные покрытия, вследствие более высоких температур (до 200000С) позволяют наносить покрытия из тугоплавких металлов (W, Ti, Ta, Zr), оксидов Al2O3, SiO2, Cr2O3, TiO2, BeO), карбидов (Cr2C3, B4C, TiC, ZrC, WC, SiC и т.д.), силицидов типа TiSi2, MoSi2, нитридов (TiN, ZrN, AlN), металлооксидные покрытия (керметы), керамики и т.д. Так, на графитовые сопла ракеты “Поларис” напыляют слой Та толщиной 50-75 мкм, затем – слой W толщиной около 1.3 мкм.
Преимуществами напыленных покрытий являются высокая производительность, возможность получения металлических, композиционных и органических покрытий, экономичность процессов, возможность нанесения на поверхности крупногабаритных изделий, легкая переналадка оборудования и т.д.
Диффузионные покрытия получают обогащением поверхностного слоя основного металла химическими элементами способом диффузии. Этот метод можно рассматривать как поверхностное легирование. Получение термодиффузионных покрытий возможно для металлов, образующих твердый раствор с покрытием. Для железных сплавов это: Al, Cr, Si, Cu, Au, Be, Zn, B, Ti, C, V, Nb, Ta, Mo, W, Mn. На практике жаростойкие диффузионные покрытия на железных сплавах изготавливают, используя насыщение поверхности алюминием, хромом, кремнием. В зависимости от материала покрытия (Аl, Сг или Si) процессы называются алитированием, термохромированием и термосилицированием. Термодиффузионные покрытия получают, используя порошкообразные смеси в расплавленных средах, в газовых восстановительных атмосферах, в атмосфере хлора или в вакууме.
Наиболее распространен способ получения термодиффузионных покрытий в порошкообразных смесях. Покрываемые детали, очищают от окалины, ржавчины, грязи пескоструйными аппаратами, травлением в горячих растворах H2SО4 или НСl и помещают в реактор, наполненный реакционной смесью. Смесь состоит из порошка наносимого элемента или его сплава с железом (ферросплава), порошка А12О3, который не позволяет порошку наносимого элемента спекаться и прилипать к поверхности покрываемой детали, и добавки 2 - 5% NH4Cl. Реактор помещается в нагретую печь (900 - 950°С) и выдерживают в ней определенное время (рис. 3.6).
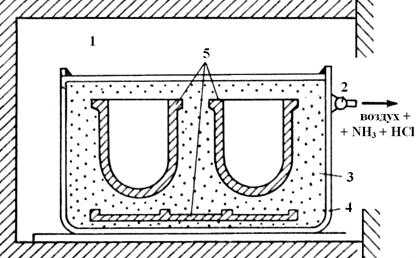
Рис. 3.6. Схема алитирования: 1 – печь, 2 – клапан, 3 – порошкообразная смесь Al + Al2O3 + NH4Cl, 4 – форма, 5 – изделия.
При нагревании реактора в печи происходит разложение хлористого аммония на аммиак и хлористый водород: NH4Cl = NH3 + НСl, которые вытесняют из реактора воздух, предотвращая окисление деталей и наносимого элемента.
Насыщение поверхности стали легирующим элементом осуществляется в результате диффузии при контакте поверхности стали с порошком и вследствие переноса элемента (А1, Сг или Si) образующимися летучими хлоридами: 2 Al + HCl = 3H2 + 2 AlCl3. Хлориды реагируют с поверхностью стали: АlСl3 + Fe = FeCl3 + Al.
Выделяющиеся при этом атомарные Al (Сr и Si, в зависимости от смеси), диффундируют в сталь, образуя сплав переменного состава, толщина которого h зависит от продолжительности выдержки, τ, (уравнение 2.23), и температуры диффузионного насыщения (рис. 3.7, а).
По экспериментальным данным скорость насыщения изделия при термодиффузионном способе нанесения покрытий в основном лимитируется диффузией легирующего компонента в металлической основе. Кинетику процесса насыщения можно описать нестационарным уравнением диффузии 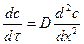 . Согласно реальным условиям процесса – это решение задачи для полубесконечного тела с постоянной концентрацией на поверхности:
. Согласно реальным условиям процесса – это решение задачи для полубесконечного тела с постоянной концентрацией на поверхности: 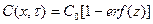 , где: С0 - постоянная концентрация диффундирующего вещества в поверхностном слое металла; C(х, τ) - концентрация по глубине в момент времени τ, отсчитываемого от начала процесса насыщения; erf(z) – трансцендентная функция Крампа или интеграл ошибок, зависящий от параметра
, где: С0 - постоянная концентрация диффундирующего вещества в поверхностном слое металла; C(х, τ) - концентрация по глубине в момент времени τ, отсчитываемого от начала процесса насыщения; erf(z) – трансцендентная функция Крампа или интеграл ошибок, зависящий от параметра 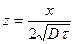 , который, в свою очередь, определяется величинами х, τ и коэффициентом диффузии D вводимого вещества в материале изделия. Значение интеграла ошибок erf(z) для конкретного D может быть найдено из таблицы 3 приложения. Зная С0, можно определить и значение C(х, τ).
, который, в свою очередь, определяется величинами х, τ и коэффициентом диффузии D вводимого вещества в материале изделия. Значение интеграла ошибок erf(z) для конкретного D может быть найдено из таблицы 3 приложения. Зная С0, можно определить и значение C(х, τ).
Существенное влияние на скорость процесса оказывает температура насыщения, что обусловлено экспоненциальным характером температурной зависимости коэффициента диффузии (уравнение 2.41).
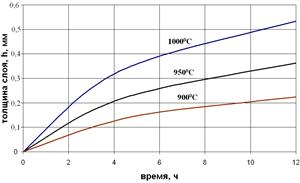
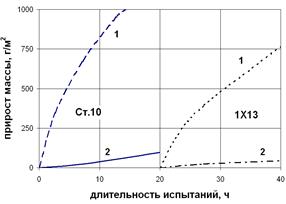
Рис. 3.7. Влияние времени алитирования (а) сплава Fe – Al + 0,5% NH4Cl на толщину алитированного слоя стали 10, и жаростойкость сталей 10 и 1Х13 на воздухе при 10000С: 1 – сталь без покрытия, 2 – алитированная сталь.
Значительное повышение жаростойкости изделий с термодиффузионными покрытиями (рис. 3.7, б) обусловлено образованием на поверхности сплавов оксидов Аl2O3, Сr2O3, SiO2, или двойных оксидов FeAl2О4, FeCr2O4, Fe2SiO4, обладающих повышенными защитными свойствами и препятствующих дальнейшему окислению.
Аналогично осуществляется термохромирование и термосилицирование. Так, получение хромовых покрытий (термохромирование) происходит с использованием порошка Cr или Cr – Fe при 900 – 11000С в течение 8 -16 ч, в результате чего образуются слои покрытия толщиной 10 – 200 мкм.
Горячий способ получения покрытий основан на погружении основного покрываемого метала в расплавленный металл. Этот наиболее старый метод применяется для нанесения покрытий из легкоплавких металлов (Al, Zn, Sn, Pb и др.). В качестве жаростойких покрытий используют алитирование. Однако Al образует с железом твердые и хрупкие сплавы типа AlFe, Al2Fe, Al3Fe, для чего в расплав добавляют олово или другие металлы. Заготовку сначала помещают в ванну с флюсом, затем – с расплавленным металлом. Флюс для защиты от окисления обычно содержит NH4Cl + ZnCl2 + глицерин.
Конденсационный способ получения покрытий основан на получение покрытия при испарении в вакууме наносимого материала, созданием направленного потока его частиц с последующим осаждением на поверхности основного покрываемого металла. При вакуумном напылении нагрев металла производится электронно-лучевой пушкой в вакууме с разрежением порядка 10-7 – 10-8 атм. Расплавленные пары напыляемого металла с помощью магнитной отклоняющей системы направляются на поверхность основного металла. Разновидностью способы является катодное распыление, при котором получение покрытия осуществляется распылением материала катода при газовом разряде. Переход материала катода в газовую фазу может происходить в результате испарения при нагревании или под действием бомбардирующих ионов. Испарение катода осуществляется за свет сопротивления (аналогично катоду в радиолампах), индукционного нагрева, электронно-лучевых пучков, электрической дуги. Наибольшее распространение получили магнетронный и вакуумно-дуговые методы катодного распыления.
Детонационный способ получения покрытий основан на получении покрытий из диспергированных материалов при взрыве горючих газов.
Вжигание (металлирование) основано на получении покрытий нагреванием диспергированного материала с флюсом и связующим веществом, нанесенного на поверхность покрываемого металла, в результате чего наносимый материал “припекается” или сплавляется c основным. Для покрытий используются порошкообразные металлы, сплавы, карбиды, нитриды, бориды и т.д. Технология получения покрытий состоит в нанесении на подготовленную поверхность деталей порошкового слоя и термической или термомеханической обработки, в процессе которой формируется спеченное покрытие.
Электрохимический способ получения покрытий в электролитах под действием электрического тока от внешнего источника основан на осаждении металлов на основной металл. Гальванические покрытия имеют ограниченное применение в качестве жаростойких, поскольку имеют небольшую толщину и низкую адгезию к основному металлу, они применяются при относительно невысоких температурах или для кратковременной защиты.
НЕМЕТАЛЛИЧЕСКИЕ ПОКРЫТИЯ
Эмалирование - получение покрытий расплавлением силикатных материалов на поверхности покрываемого металла. Защитные свойства эмалей обеспечиваются сплавлением стеклообразных керамических составляющих, основу которых составляет кремнезем SiO2, и состоящих из неорганических оксидов (Сr2О3, Аl2О3, ТiO2, ZnO, SiО2), оказывающих высокое сопротивление диффузии и повышающих жаростойкость стали, и минимального количества оксидов PbO, Na2О, СаО, облегчающих протекание диффузии в окалине и понижающих жаростойкость стали. Недостатком эмалей является хрупкость, недостаточная устойчивость к ударным нагрузкам и колебаниям температуры. В состав шихты жаростойких эмалей обычно входит кварцевый песок, Н3ВО3, ВаСО3, СаСО3, ТiO2, ZnO, которые сплавляют с последующим размолом застывшей остеклованной массы. Полученную водную суспензию наносят на металл, сушат и обжигают. Подобные эмали предназначены для защиты стальных деталей от окисления в газовых средах при температурах до 1000°С. Эмали на основе Сr2О3, Аl2О3, ZrO2, Y2O3 используются для защиты от газовой коррозии до 14000С. Методы нанесения эмалей аналогичны металлическим покрытиям.
Из других неметаллических жаростойких покрытий используются: фторопластовые (тефлоновые) покрытия (до 2500С), органосиликатные покрытия из теплостойких лаков на основе кремнеорганических полимеров с формулой R3SiO[RSiO1,5]nSiR3, где R- CH3, C2H5 и т.д. Для повышения жаростойкости в них вводят Cr2O3, TiO2 и др. Кроме них используют покрытия на основе силоксановых лаков – полимерных кислородных соединениях кремния -O-Si-O-Si-O-Si-. Кремнеорганические покрытия работоспособны при температурах до 500 - 6000С.
Газотермический способ нанесения покрытий распылением позволяет наносить неметаллические материалы и пластмассы.
Наибольшую жаростойкость имеют покрытия из тугоплавких соединений - карбидов, нитридов, боридов, силицидов (до 20000С), керамические (например, ZrO2 + Al2O3 + ТiO2), и композиционные покрытия, состоящие из включений металлических и неметаллических составляющих. Композиционные покрытия - металлокерамические покрытия типа Cr-Al2O3; Al-Al2O3; Mo-ZrO2; W-ZrB2; W-ThO2; W-HfO2 (керметы), используемые в авиационной и ракетной технике. Методы нанесения этих покрытий аналогичны нанесению металлических покрытий с преобладанием плазменного напыления.
Защитные атмосферы
Применение защитных атмосфер при термообработке металлов позволяет отказаться от операций по очистке от окалины, которая к тому же нарушает геометрические размеры деталей, и дает экономию металла до 3,5%.
Общий принцип подбора атмосфер состоит в создании безокислительных условий, ∆GT>0, т.е. в соблюдении условия 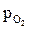 <
< 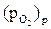 , при котором окисление термодинамически невозможно.
, при котором окисление термодинамически невозможно.
Состав защитных атмосфер можно рассчитать из констант кривых равновесия газовых атмосфер с металлом. Практическое применение получили защитные атмосферы на основе газов: Ar2, He2, N2 (нейтральные); Н2, СО, СН4 (восстанавливающие); О2, СО2, пары Н2О (окисляющие); СО2 и пары Н2О (обезуглероживающие для сталей); СО, СН4 (науглероживающие для сталей); и вакуума.
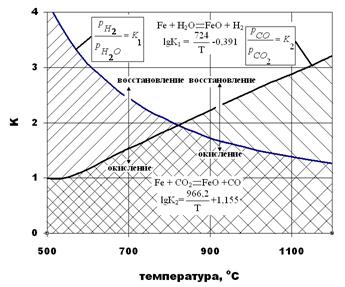
Термодинамическая возможность окисления при взаимодействии металла и окислителя определяется по константам равновесия соответствующих реакций в зависимости от температуры. При высоких температурах возможность протекания реакций:
Fe + Н2О 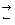 FeO + H2 (3.1)
FeO + H2 (3.1)
Fe + CO2 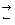 FeO + CO, (3.2)
FeO + CO, (3.2)
определяется константами равновесия соответствующих реакций К1= 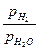 и К2=
и К2= 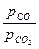 , зависимость которых от температуры приведена на рис. 3.8. На рис. 3.8, а область восстановления не заштрихована, в этой области окисления Fe не происходит. В заштрихованных областях железо окисляется. Так, для газовой смеси, состоящей из 45% СО + 15%СО2 + N2 (остальное) константа равновесия К2=
, зависимость которых от температуры приведена на рис. 3.8. На рис. 3.8, а область восстановления не заштрихована, в этой области окисления Fe не происходит. В заштрихованных областях железо окисляется. Так, для газовой смеси, состоящей из 45% СО + 15%СО2 + N2 (остальное) константа равновесия К2= 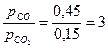 , (рис.3.8, а). Равновесие Fe и FeO в газовой смеси данной концентрации согласно кривой К2 соответствует температуре 11300С. При более высоких температурах происходит окисление Fe, при более низких - восстановление Fe из FeO.
, (рис.3.8, а). Равновесие Fe и FeO в газовой смеси данной концентрации согласно кривой К2 соответствует температуре 11300С. При более высоких температурах происходит окисление Fe, при более низких - восстановление Fe из FeO.
а б
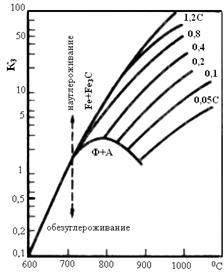
Рис. 3.8. Влияние температуры на константы равновесия реакций 3.1 и 3.2 (а), и реакции (3.3).
В качестве защитных сред часто используют атмосферу СО + СО2, в которой в сталях может происходить науглероживание или обезуглероживание по реакции:
Fe3C + CO = 3Fe + 2CO (3.3)
Константа равновесия этой реакции К3= 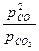 приведена на рис. 3.8, б. Так для среды с содержанием 45% СО и 15%СО2 при 8000С К3=
приведена на рис. 3.8, б. Так для среды с содержанием 45% СО и 15%СО2 при 8000С К3= 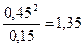 углеродистая сталь с любым содержанием углерода будет обезуглероживаться. При этой же температуре среда с К3 = 6 будет обезуглероживать стали с содержанием менее 0,8%С, и науглероживать стали, содержащие более 0,8%С. Для получения стали с содержанием 0,1%С её надо выдержать в смеси данного состава при температуре около 9750С.
углеродистая сталь с любым содержанием углерода будет обезуглероживаться. При этой же температуре среда с К3 = 6 будет обезуглероживать стали с содержанием менее 0,8%С, и науглероживать стали, содержащие более 0,8%С. Для получения стали с содержанием 0,1%С её надо выдержать в смеси данного состава при температуре около 9750С.
Кроме защитных атмосфер из баллонных газов для сталей используются защитные атмосферы смеси газов:
1. Н2 + H2O + N2,
2. CO + CO2 + N2,
3. CO + CO2 + H2 + H2O + N2,
4. CO + CO2 + H2 + CH4 + N2,
5. N2 + H2.
1. Атмосферу Н2 + H2O + N2 получают диссоциацией аммиака. При нагревании NH4 испаряется и диссоциирует (2NH4 = N2 + 3H2) в присутствии катализаторов – железных стружек или оксидов Fe2О3 и Fe3О4, и затем осушается. Примерный получаемый состав такой атмосферы 75% Н2 + 25% N2. Атмосфера взрывоопасна, и в ней возможны реакции:
FeO + H2 D Fe + H2O, (3.4)
(почему для снижения содержания паров H2O ниже равновесного (~0,01%) атмосферу осушают), и:
Fe3C + 2H2 D 3Fe + CH4, (3.5)
почему для уменьшения обезуглероживания в атмосфере снижают содержание водорода.
Это достигается частичным сжиганием аммиака и водорода при пропускании диссоциированного аммиака над раскаленными тонкодисперсными катализаторами на основе Fe, Ni, Pd, Pt. Так получают атмосферу состава 1 -15% Н2 – остальное N2, которую затем осушают от паров воды. При осушке газа через расплавленный литий, следы последнего остаются в защитной атмосфере, связывая остаточные пары воды и кислорода. Эта “литиевая” атмосфера обеспечивает “светлый” отжиг.
2. Атмосферу CO + CO2 + N2 получают генераторным процессом из древесных, древесноугольных и каменноугольных углей. В ней возможны реакции 3.2 и 3.3.
3. Атмосферу CO + CO2 + H2 + H2O + N2, которая наиболее часто используется в практике промышленной термообработки, получают сжиганием природных или генераторных газов с различной степенью осушки.
4. Атмосферу CO + CO2 + H2 + CH4 + N2 получают крекингованием углеводородных газов или нефтепродуктов.
Как и диссоциирован
Дата добавления: 2017-02-13; просмотров: 6208;











