Основы молекулярно-кинетической теории теплоемкости
Известно, что внутренняя энергия газа равномерно распределяется между степенями свободы молекулы. Числом степеней свободы δ молекулы называют число координат, определяющих положение молекулы в пространстве.
Молекула одноатомного газа имеет только поступательное движение, которое можно разложить на три составляющие по направлению осей координат х, y и z. Таким образом, положение такой молекулы определяется тремя координатами, а число степеней свободы соответственно равно трем: δ= 3.
При движении двухатомной молекулы кроме поступательного движения необходимо учитывать и вращательное движение около осей х и y, в связи с чем двухатомные молекулы имеют три степени свободы поступательного движения и две степени свободы вращательного движения, т.е. всего пять степеней свободы δ= 5.
Трехатомная молекула, а также многоатомная молекула имеют три степени свободы поступательного движения и три степени свободы вращательного, т.е. всего шесть степеней свободы δ= 6.
Теплоемкость и показатель адиабаты для одноатомных газов не зависят от температуры. Теплоемкости двухатомных и многоатомных газов с ростом температуры увеличиваются, а показатели адиабаты уменьшаются.
Согласно молекулярно-кинетической теории, мольные теплоемкости идеальных газов определяются следующими уравнениями:
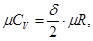 (1.11)
(1.11)
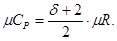 (1.12)
(1.12)
Экспериментальные данные качественно подтверждают значения молярных теплоемкостей, найденных расчетным путем. Однако определенное расхождение между ними свидетельствует о том, что молекулярно-кинетическая теория не учитывает внутримолекулярного движения атомов и сил взаимодействия между молекулами. Последнее может быть учтено лишь с помощью квантовой теории.
Дата добавления: 2017-01-26; просмотров: 2173;











