Процессы фазового перехода
Фазовым переходом называют переход вещества из одной фазы в другую. Одно и тоже вещество в зависимости от внешних условий (давления и температуры) может находиться в различных агрегатных состояниях.
Вещество в разных агрегатных состояниях имеет различные физические свойства и, в частности, плотность. Это различие объясняется характером межмолекулярного взаимодействия.
Фазовый переход из твердой фазы в газообразную, происходящий при очень низких давлениях, называют сублимацией. Теплота сублимации больше, чем теплота плавления и теплота парообразования.
При фазовом переходе обычно резко изменяется плотность вещества. При этом в случаях парообразования и сублимации плотность газовой фазы всегда меньше, чем плотность конденсированной фазы. Что же касается плавления, то здесь для разных веществ возможны различные случаи: плотность твердой фазы может быть либо больше, либо меньше плотности жидкости.
Принята следующая классификация точек фазового перехода: точку перехода жидкость – пар называют точкой кипения (она же точка конденсации), точку перехода твердое тело – жидкость - точкой плавления (она же точка затвердевания), а точку перехода твердое тело-пар - точкой сублимации.
На кривой фазового перехода в рТ-диаграмме состояние, в котором сосуществуют три фазы, изобразится точкой (так называемой тройной точкой). Наиболее характерной для чистого вещества является тройная точка, в которой сосуществуют твердая, жидкая и паровая фазы. Для воды тройная точка соответствует температуре 0,01 °С и давлению 611,7 Па (0,0062 кгс/см2).
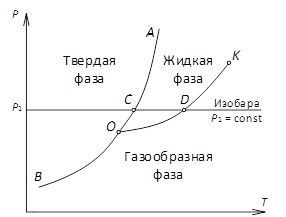
Рис. 4.1рТ – диаграмма вещества
На рис. 4.1 изображена характерная рТ-диаграмма вещества с нанесенными на ней кривыми фазовых переходов. Влево от линии АОВ расположена область твердого состояния вещества. Справа от линии КОВ расположена область газообразного состояния вещества, а между линиями ОА и ОК ‒ область жидкого состояния. Из рТ- диаграммы следует, что линия ОВ представляет собой кривую сублимации вещества, линия ОА - кривую плавления (затвердевания), а линия ОК - кривую кипения (конденсации). Кривую кипения обычно называют кривой (или линией) насыщения. Точка О представляет собой тройную точку, в которой вещество сосуществует в трех агрегатных состояниях. Кривая сублимации ОВ продолжается вниз в сторону низких температур. Кривая плавления ОА уходит вверх, в сторону больших давлений. Линия насыщения ОК оканчивается в точке К, называемой критической точкой. Поскольку свойства разных веществ отличаются друг от друга, то и рТ-диаграммы будут различными для различных веществ.
При достижении критических параметров (температуры и давления) вещество переходит сверхкритическое состояние. Выше критических параметров двухфазное состояние не достижимо. В сверхкритическом состоянии имеются свободные молекулы и многочисленные слабо связанные кластеры молекул. Расстояние между частицами (молекулами и кластерами) значительно больше, чем в классической жидкости, но намного меньше, чем в обычных газах. Внутри кластеров молекулы располагаются хаотично. Энергия взаимодействия молекул в кластерах мала. В то же время скорости, с которыми отдельные молекулы входят в кластеры и покидают их, очень высоки. Отсюда вытекает исключительно низкая вязкость и одновременно высокая диффузионная способность сверхкритической среды. Плотность сверхкритической среды близка к плотности жидкости, что обеспечивает высокую растворяющую способность. Совокупность этих свойств лежит в основе практического использования веществ в сверхкритическом состоянии.
Из рис. 4.1 видно, что линия сублимации и линия насыщения имеют положительный наклон. Это означает, что с ростом давления температура фазового перехода (сублимация и кипение) повышается. Такая закономерность справедлива для всех известных чистых веществ. Линия плавления для различных веществ может иметь как положительный, так и отрицательный наклон.
Из рТ-диаграммы (рис. 4.1) видно также, как изменяется состояние вещества в процессе нагрева при постоянном давлении. Двигаясь по изобаре р1 = const из области, соответствующей твердому состоянию вещества, линия плавления пересекается в точке С – вещество переходит в жидкое состояние. При дальнейшем нагреве пересекается линия насыщения ОК в точке D – вещество превращается в пар. Дальнейшее продвижение по изобаре р1 = const в сторону больших температур соответствует нагреву вещества в газовой фазе.
Дата добавления: 2017-01-26; просмотров: 2940;











