Виды теплоемкостей и связь между ними
ОПРЕДЕЛЕНИЕ ТЕПЛОЕМКОСТИ ВОЗДУХА
Под удельной теплоемкостью вещества понимают количество теплоты, которое нужно сообщить или отнять от единицы вещества (1 кг, 1 м3, 1 моль), чтобы изменить его температуру на один градус.
В зависимости от единицы заданного вещества различают следующие удельные теплоемкости:
- массовую теплоемкость С, отнесенную к 1 кг газа, Дж/(кг∙К);
- молярную теплоемкость µС, отнесенную к 1 кмолю газа, Дж/(кмоль∙К);
- объемную теплоемкость С′, отнесенную к 1 м3 газа, Дж/(м3∙К).
Удельные теплоемкости связаны между собой соотношением:
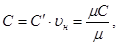 (1.1)
(1.1)
где υн - удельный объем газа при нормальных условиях (н.у.), м3/кг; µ - молярная масса газа, кг/кмоль.
Теплоемкость идеального газа зависит от характера процесса подвода (или отвода) теплоты, от атомности газа и температуры (теплоемкость реальных газов зависит также от давления).
Связь между массовыми изобарной СP и изохорной СV теплоемкостями устанавливается уравнением Майера:
СP - СV = R, (1.2)
где R – газовая постоянная, Дж/(кг∙К).
При нагревании идеального газа в замкнутом сосуде постоянного объема теплота расходуется только на изменение энергии движения его молекул, а при нагревании при постоянном давлении, благодаря расширению газа, одновременно совершается работа против внешних сил.
Для молярных теплоемкостей уравнение Майера имеет вид:
µСр - µСv = µR, (1.3)
где µR=8314Дж/(кмоль∙К) – универсальная газовая постоянная.
Объем идеального газа Vн, приведенный к нормальным условиям, определяется из следующего соотношения:
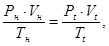 (1.4)
(1.4)
где Рн – давление при нормальных условиях, Рн = 101325 Па = 760 мм рт ст; Тн – температура при нормальных условиях, Тн = 273,15 K; Pt, Vt, Tt – рабочие давление, объем и температура газа.
Отношение изобарной теплоемкости к изохорной обозначают k и называют показателем адиабаты:
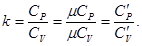 (1.5)
(1.5)
Из (1.2) и с учетом (1.5) получаем:
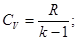
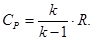 (1.6)
(1.6)
Для точных расчетов средняя теплоемкость определяется по формуле:
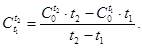 (1.7)
(1.7)
В тепловых расчетах различного оборудования часто определяется количество тепла, которое требуется для нагрева или охлаждения газов:
Q = C∙m∙(t2 - t1), (1.8)
Q = C′∙Vн∙(t2 - t1), (1.9)
где Vн – объем газа при н.у., м3.
Q = µC∙ν∙(t2 - t1), (1.10)
где ν – количество газа, кмоль.
Дата добавления: 2017-01-26; просмотров: 9335;











