Электрофильное замещение в молекуле бензола
Между механизмами реакций электрофильного замещения в ароматическом ядре и электрофильного присоединения к олефинам имеется сходство. Это проявляется на первой ступени.
Электрофильная реакция замещения протекает по механизму SE2-бимолекулярному механизму через стадию промежуточного соединения и протекает ступенчато. В обоих случаях реакции предшествует быстрое образование π-комплекса. Стадией, определяющей скорость реакции, является переход π-комплекса в промежуточный карбониевый ион при ароматическом замещении в σ-комплекс.
Электрофильное присоединение у олефинов (1 стадия):


 СН2 = СН2 + Х+ СН2 = СН2 СН2 – СН2+
СН2 = СН2 + Х+ СН2 = СН2 СН2 – СН2+
Х+ Х
π-комплекс σ-комплекс
Электрофильное замещение у аренов (1 стадия):






 Н Х
Н Х

 + Х+ Х+ ••
+ Х+ Х+ ••
+
π-комплекс σ-комплекс
На первой стадии у аренов происходит взаимодействие π-молекулярных орбиталей ароматического соединения со свободной р-орбиталью электрофила (Х+), которое приводит к образованию донорно-акцепторного π-комплекса. Этот π-комплекс в результате внедрения электрофильного реагента в π-электронную систему ароматического соединения медленно превращается в положительно заряженный σ-комплекс с образованием ковалентной σ-связи (Х+ – ароматическое соединение). Электрофил (Х+) выхватывает 2 электрона из π-электронного секстета, превращая атакуемый атом углерода из sp2-гибридного состояния в sp3-состояние, преобразуя его в тетраэдрический. Связанные с ним заместитель(Х) и атом водорода располагаются вне плоскости кольца, перпендикулярно плоскости кольца:




 Н (м) +1/3(о) Н
Н (м) +1/3(о) Н














 (n) +1/ • •
(n) +1/ • •




 Х или • • Х
Х или • • Х
(м) +1/3(о)
σ-Комплекс – это катион, лишенный ароматической структуры, с четырьмя π-электронами, делокализованными в сфере воздействия ядер пяти углеродных атомов. Образование σ-комплекса не требует большой затраты энергии. σ-Комплекс – это не переходное состояние, а настоящее промежуточное соединение.
Промежуточный σ-комплекс имеет несколько резонансных структур, положительный заряд в нем распределяется по трем из пяти доступных р-орбиталей атомов углерода. Эта система включает два одинаковых орто-углеродных атома по отношению к sp3-гибридизованному атому углерода и один пара-углеродный атом. Два мета-положения кольца не несут формального заряда, но они, несомненно, имеют слегка электроположительный характер из-за соседних положительно заряженных атомов углерода:







 Н Х Н Х Н Х Н Х Н Х
Н Х Н Х Н Х Н Х Н Х











 ••
•• 
 δ+ δ+
δ+ δ+



 + +
+ +
δ+ +
Вторые стадии реакций электрофильного присоединения и электрофильного замещения протекает различно. При ароматическом замещении лабильный σ-комплекс превращается в стабильный замещенный бензол с потерей протона. При этом выигрывается разница в энергии сопряжения в ароматическом кольце и в σ-комплексе.
В случае олефинов потеря протона не приведет к выигрышу энергии, и промежуточный катион быстро реагирует с анионом или нуклеофильной молекулой с образованием продуктов присоединения.
Электрофильное замещение у аренов (2 стадия): 






 Н Х Х
Н Х Х


 •• реароматизация (быстро)
•• реароматизация (быстро)
+ Н+
σ-комплекс замещенный бензол
Электрофильное присоединение у олефинов (2 стадия):
 N
N


 СН2 – СН2+ + N– CH2 – CH2
СН2 – СН2+ + N– CH2 – CH2
Х Х
σ-комплекс нуклеофил продукт присоединения
 Е
Е

 Еа
Еа
В
 | |||
 | |||
σ
 | |||
 | |||
А π
С Δ Н
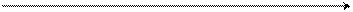 ход реакции
ход реакции
Энергетический профиль реакции SE2 в ароматическом ряду
А-исходное соединение,
π- комплекс,
В-σ-комплекс,
Еа – энергия активации σ-комплекса,
С – продукт реакции,
Δ Н – тепловой эффект реакции.
Примером реакции SE2 в ароматическом ряду является реакция галогенирования бензола. В качестве катализатора применяется кислота Льюиса – AlCl3, который способствует образованию электрофильной частицы.
 Cl
Cl

 AlCl3
AlCl3


 + Сl2 + HCl
+ Сl2 + HCl
бензол хлорбензол
Функция катализатора – это связывание галогена:

 Cl Cl
Cl Cl





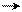 δ+Cl Clδ– Al – Cl Clδ+ Cl+ Al– – Cl
δ+Cl Clδ– Al – Cl Clδ+ Cl+ Al– – Cl
Cl Cl
Связь в молекуле хлора сильно поляризуется и вследствие отрицательного индуктивного эффекта внешний атом хлора приобретает положительный заряд. Этот комплекс и реагирует с бензолом. Π-Связь молекулы бензола служит нуклеофилом и оттесняет группу AlCl4– от крайнего атома хлора. Этот атом атакует бензольное кольцо и образуется бензониевый ион:
 Н Н
Н Н






 Н Н Н Н
Н Н Н Н
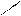



 Cl Cl
Cl Cl







 Clδ+ Cl+ Al– – Cl + + AlCl4–
Clδ+ Cl+ Al– – Cl + + AlCl4–

 Н Н Cl Н Н
Н Н Cl Н Н
Н Н
комплекс «хлор-катализатор» бензониевый ион
Затем бензониевый ион теряет протон и происходит реароматизация системы:

 Н Н
Н Н





 Н Н Н Cl
Н Н Н Cl


 Cl
Cl




 + – Н+
+ – Н+

 Н Н Н Н
Н Н Н Н
Н Н
бензониевый ион хлорбензол
Образующийся протон взаимодействует с анионом AlCl4– , в результате чего образуется побочный продукт НCl, и катализатор восстанавливается:
 Н+ + AlCl4– НCl + AlCl3
Н+ + AlCl4– НCl + AlCl3
Так как катализатор регенерируется, его надо брать в реакцию замещения в небольшом количестве.
Дата добавления: 2017-01-16; просмотров: 1708;











