Кислородсодержащие органические соединения.
Фенолы
Фенолами называются производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп, непосредственно соединенных с бензольным кольцом.
Простейший представитель этого класса С6Н5ОН – фенол.
Строение фенола. Одна из двух неподеленных электронных пар атома кислорода втягивается в  - электронную систему бензольного кольца. Это приводит к двум эффектам: а) увеличивается электронная плотность в бензольном кольце, причем максимумы электронной плотности находятся в орто – и пара – положениях по отношению к группе ОН;
- электронную систему бензольного кольца. Это приводит к двум эффектам: а) увеличивается электронная плотность в бензольном кольце, причем максимумы электронной плотности находятся в орто – и пара – положениях по отношению к группе ОН;
б) электронная плотность на атоме кислорода напротив, уменьшается, что приводит к ослаблению связи О - Н. Первый эффект проявляется в высокой активности фенола в реакциях электрофильного замещения, а второй – в повышенной кислотности фенола по сравнению с предельными спиртами.
Монозамещенные производные фенола, например метилфенол (крезол), могут существовать в виде трех структурных изомеров орто - , мета - , пара - крезолов:


 ОН ОН ОН
ОН ОН ОН
СН3
СН3
СН
о – крезол м – крезол п – крезол
Получение. Фенолы и крезолы содержатся в каменноугольной смоле, а также в нефти. Кроме того, образуются при крекинге нефти.
В промышленности фенол получают:
1) из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол: С6Н5Сl + 2NaOH → С6Н5ONa + NaCl + H2O;
С6Н5Сl + H2SO4 → С6Н5OH + NaHSO4;
2) при каталитическом окислении изопропилбензола (кумола) кислородом воздуха, при этом образуются фенол и ацетон.

 СН3―СН―СН3 ОН
СН3―СН―СН3 ОН
+ О2  + СН3―С―СН3.
+ СН3―С―СН3.
||
О
Это основной промышленный способ получения фенола.
3)фенол получают из ароматических сульфокислот. Реакция проводится при сплавлении сульфокислот со щелочами. Первоначально образующиеся феноксиды обрабатывают сильными кислотами для получения свободных фенолов.

 SO3H ONa
SO3H ONa
+ 3NaOH → + Na2SO3 + 2H2O.
феноксид натрия
Физические свойства. Простейшие фенолы – вязкие жидкости или низкоплавкие твердые вещества с характерным карболовым запахом. Фенол растворим в воде (особенно в горячей), другие фенолы – мало растворимы. Большинство фенолов – бесцветные вещества, однако при хранении на воздухе темнеют за счет продуктов окисления.
Химические свойства.
1. Кислотность фенола выше, чем у предельных спиртов; он реагирует как со щелочными металлами
2С6Н5ОН + 2Na → 2С6Н5ОNa + Н2↑,
так и с их гидроксидами:
С6Н5ОН + NaОН → С6Н5ОNa + Н2О.
Фенол, однако, является очень слабой кислотой. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол. Это доказывает, что фенол – более слабая кислота, чем угольная или сернистая.
С6Н5ОNa + СО2 + Н2О → С6Н5ОН + NaНСО3.
2. Образование сложных эфиров. Они образуются при действии на фенол хлорангидридов карбоновых кислот (а не самих кислот, как в случае спиртов). O
||
С6Н5ОН + СН3СОСl → C6H5―C―CH3 + HCl.
фенилацетат
3. Образование простых эфиров происходит при взаимодействии фенола с галогеналканами.
С6Н5ОН + С2Н5Сl → С6Н5―О― С2Н5.
фенилэтиловый эфир
4. Реакции электрофильного замещения с фенолом протекают значительно легче, чем с ароматическими углеводородами. Поскольку ОН группа является ориентантом I рода, то в молекуле фенола увеличивается реакционная способность бензольного кольца в орто – и пара – положениях.
 а) бромирование. При действии бромной воды на фенол три атома водорода замещаются на бром и образуется осадок 2, 4, 6 – трибромфенола: ОН
а) бромирование. При действии бромной воды на фенол три атома водорода замещаются на бром и образуется осадок 2, 4, 6 – трибромфенола: ОН
 ОН Br Br
ОН Br Br
+ 3Вr2 → + 3HBr.
Br
Это качественная реакция на фенол.
б) нитрование. 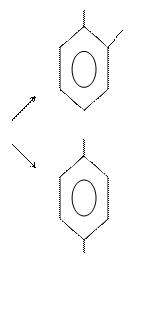 ОН
ОН
NO2
 ОН
ОН
о–нитрофенол
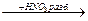 ОН + Н2О.
ОН + Н2О.
п–нитрофенол
NO2

 ОН ОН
ОН ОН
NO2 NO2
+ 3НNO3 конц → + 3H2O.
NO2
2,4,6 – тринитрофенол
(пикриновая кислота)
г) сульфирование.
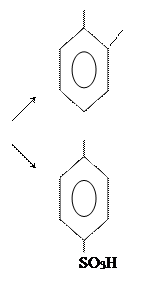 ОН
ОН
SO3H
 ОН
ОН
+ Н2SO4 конц. OH + H2O.
д) окисление.


 ОН О ОН
ОН О ОН

|
ОН
Применение. Фенол в виде 5 % водного раствора (карболовая кислота) используется в качестве дезинфицирующего средства, применяется в производстве фенол - формальдегидных смол, красителей, взрывчатых веществ, лекарственных препаратов.
О - , м - , п - крезолы (СН3―С6Н4―ОН) используют в производстве пластмасс и красителей, в виде смеси с мылами – как дезинфицирующее средство в ветеринарной практике.
Дата добавления: 2018-11-26; просмотров: 1555;











