Циклоалканы (нафтены)
Циклоалканы – это предельные циклические углеводороды. Общая формула гомологического ряда циклоалканов СnH2n. Каждому циклоалкану изомерен соответствующий алкен , то есть имеет место межклассовая изомерия.
Строение. Каждый атом углерода в циклоалканах находится в состоянии sp3 – гибридизации.
Изомерия и номенклатура. 1. Для циклоалканов характерна изомерия углеродного скелета (структурная изомерия). Структурная изомерия, во-первых, обусловлена размером цикла. Например, существуют два циклоалкана с формулой С4Н8:
СН3
| СН3




 Н2С СН2 СН
Н2С СН2 СН
Н2С СН2 Н2С СН2
циклобутан метилциклопропан
Во-вторых, такая изомерия обусловлена положением заместителей в цикле, например:

 Н3С СН3 СН3
Н3С СН3 СН3
СН3
1,1 – диметилциклопропан 1,2 – диметилциклопропан
2. Отсутствие свободного вращения вокруг связей С―С в цикле создает предпосылки для существования пространственных изомеров у некоторых замещенных циклоалканов, например в молекуле 1,2 – диметилциклопропана:
 Н Н
Н Н

 |  | ||
СН3 СН3 СН3 Н



 Н Н
Н Н
 | |||
 | |||
Н Н Н СН3
цис-форма транс-форма
tкип. = 37 ºС, ρ = 0,693 г/см3 tкип .= 29 ºС, ρ = 0,677 г/см3
По размеру цикла циклоалканы можно разделить на малые (С3,С4) и обычные (С5,С6)циклы.
Названия циклоалканов строятся путем добавления приставки цикло- к названию алкана с соответствующим числом атомов углерода. Нумерацию в цикле производят таким образом, что бы заместители получили наименьшие номера.
Способы получения.Циклопентан и циклогексан содержатсяв нефти (Марковников выделил их из Бакинской нефти).
1. В промышленностициклоалканы получают гидрированием бензола на никелевом катализаторе:
С6Н6 + 3Н2 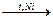 С6Н12.
С6Н12.
2. В лабораторных условиях циклоалканы получают:
а) циклизацией дигалогеналканов;
 CН2―Вr CН2
CН2―Вr CН2
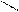 (СН2)n +Mg(Zn)
(СН2)n +Mg(Zn) 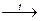 (СН2)n + MgBr2(ZnBr2);
(СН2)n + MgBr2(ZnBr2);
CН2―Вr CН2
б) дегидроциклизацией алканов.
Физические свойства.При обычных условиях первые два члена ряда (С3-С4) – газы, (С5-С16) – жидкости, начиная с С17 – твердые вещества. Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов.
Химические свойства.По химическим свойствам малые и обычные циклы существенно различаются между собой. Циклопропан и циклобутан склонны к реакциям присоединения, то есть сходны с алкенами. Циклопентан и циклогексан по своему химическому поведению близки к алканам, так как вступают в реакции замещения.
1. Бромирование (идет с разрывом цикла).
СН2
 |
+Вr2 → Br―CH2― CH2― CH2― Br.
Н2С СН2
2. Гидрирование.
 а)
а)
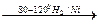 CH3― CH2― CH3;
CH3― CH2― CH3;
 б)
б)
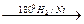 CH3― CH2―CH2― CH3;
CH3― CH2―CH2― CH3;
 в)
в)
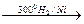 CH3―CH2―CH2―CH2―CH3.
CH3―CH2―CH2―CH2―CH3.
С увеличением цикла возрастают трудности разрыва кольца, что наглядно видно из приведенных выше схем.
3. В реакцию присоединения галогеноводородов вступают только малые циклы. Присоединение к гомологам циклопропана происходит по правилу Марковникова.
Н3С―СН
 |
+ НВr → CH3― CH―CH2― CH2.
| |
Н2С СН2 Br H
4. Реакции замещения. Обычные циклы (С6 и выше) устойчивы и вступают только в реакции радикального замещения подобно алканам:
С6Н12 + Вr2 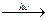 С6Н11Br + HBr;
С6Н11Br + HBr;
С6Н12 + CI2 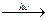 С6Н11CI + HCI.
С6Н11CI + HCI.
5. Дегидрирование циклогексана в присутствии никелевого катализатора приводит к образованию бензола:
С6Н12 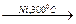 С6Н6 + 3Н2.
С6Н6 + 3Н2.
6. Окисление. При действии 50 %- ной НNO3 на циклогексан в присутствии катализатора образуется адипиновая (гександионовая) кислота.
 СН2
СН2
 СН2―СООН
СН2―СООН
 Н2С СН2 Н2С
Н2С СН2 Н2С
 Н2С СН2 Н2С
Н2С СН2 Н2С
СН2―СООН
СН2
Применение.
Циклопропан (С3Н6) – бесцветный газ, tкип= - 34,5 ºС, плохо растворим в воде, хорошо - в органических растворителях, легко воспламеняется, смесь с О2 взрывоопасна.
Применяется в медицине для общей анестезии вместо хлороформа.
Циклопентан (С5Н10) – бесцветная жидкость,tкип = 49,3 ºС, не растворим в Н2О, растворяется в органических растворителях. Используется в органическом синтезе, входит в состав моторных топлив и смазочных масел; циклопентановое кольцо входит в состав важных биологически активных соединений – простогландидов.
Циклогексан (С6Н12) – бесцветная жидкость, tкип = 80,7 °С, не растворим в Н2О, растворяется в органических растворителях. Применяется как растворитель и как сырье для получения капролактама и адипиновой кислоты.
Дата добавления: 2018-11-26; просмотров: 1043;











