НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ (АЛКЕНЫ)
Алкенами – называются непредельные углеводороды, молекулы которых содержат одну двойную связь. Общая формула гомологического ряда алкенов СnH2n. Она совпадает с общей формулой циклоалканов, поэтому алкены и циклоалканы являются межклассовыми изомерами.
Строение. Атомы углерода при двойной связи находятся в состоянии sp2 – гибридизации. Три 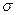 - связи, образованные гибридными орбиталями, располагаются в одной плоскости под углом 120º друг к другу (рис. 7.1);
- связи, образованные гибридными орбиталями, располагаются в одной плоскости под углом 120º друг к другу (рис. 7.1); 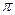 - связь образована при перекрывании негибридных 2p – орбиталей соседних атомов углерода (рис. 7.2). При этом атомные р – орбитали перекрываются не в межъядерном пространстве, а вне его.
- связь образована при перекрывании негибридных 2p – орбиталей соседних атомов углерода (рис. 7.2). При этом атомные р – орбитали перекрываются не в межъядерном пространстве, а вне его.
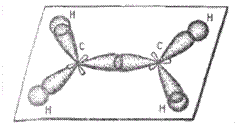
Рис. 7.1. Образование σ – связи в молекуле этилена
Поэтому такое «боковое» перекрывание менее эффективно, чем осевое, и следовательно, 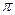 - связь является менее прочной, чем
- связь является менее прочной, чем 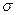 - связь. Дополнительное
- связь. Дополнительное 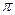 - связывание двух атомов углерода приводит к тому, что уменьшается расстояние между ядрами, поскольку двойная связь является сочетанием
- связывание двух атомов углерода приводит к тому, что уменьшается расстояние между ядрами, поскольку двойная связь является сочетанием 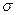 - и
- и 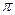 - связей. Длинна связи С = С составляет 0,133 нм, что существенно меньше простой связи (0,154 нм).
- связей. Длинна связи С = С составляет 0,133 нм, что существенно меньше простой связи (0,154 нм).
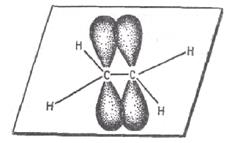
Рис. 7.2. Образование π – связи между атомами углерода в молекуле этилена
Энергия двойной связи (606 кДж/моль) меньше удвоенного значения энергии простой связи (347·2 = 694 кДж/моль). Это обусловлено меньшей энергией 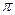 -связи.
-связи.
Изомерия.Структурная изомерия алкенов обусловлена изомерией углеродного скелета и изомерией положения двойной связи.
Примеры:
СН2=СН―СН2―СН3 СН2= С―СН3
бутен – 1 |
СН3
2-метилпропен
СН2=СН―СН2―СН3 СН3―СН=СН―СН3
бутен – 1 бутен – 2
Пространственная, или цис – транс – изомерия обусловлена различным положением заместителей относительно плоскости двойной связи.
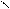
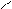 Н3С СН3
Н3С СН3 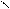
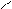 Н3С Н
Н3С Н
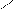
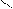
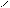
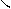 С=С С=С
С=С С=С
Н Н Н СН3
цис – бутен – 2 транс – бутен – 2
Эти два изомера нельзя перевести друг в друга без вращения вокруг двойной связи С=С, а это вращение требует разрыва π – связи и затраты большой энергии. Поэтому цис – и транс – изомеры представляют собой разные индивидуальные вещества, которые отличаются друг от друга физическими и химическими свойствами.
Номенклатура.В алкенах с неразветвленной углеродной цепью нумерацию начинают с того конца, ближе к которому находится двойная связь. В названии соответствующего алкана суффикс – ан заменяется на – ен. В разветвленных алкенах выбирают главную цепь так, чтобы она содержала двойную связь, даже если она при этом и не будет самой длинной. Перед названием главной цепи указывают номер атома углерода, при котором находится заместитель, и название этого заместителя. Номер после названия главной цепи указывает положение двойной связи, например:
1 2 3 4 5
СН3―СН=СН―СН―СН3 .
|
СН3
4 – метилпентен – 2
Получение.Алкены в небольших количествах встречаются в нефтях некоторых месторождений.
Поскольку алкены являются ценным сырьем для промышленного органического синтеза, разработаны многие способы их получения.
1. В промышленности алкены получают:
а) в результате крекинга алканов, входящих в состав нефти: С8Н18 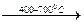 С4Н10 + С4Н8;
С4Н10 + С4Н8;
б) дегидрированием алканов:
СН3―СН2―СН3 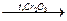 СН3―СН=СН2 + Н2.
СН3―СН=СН2 + Н2.
2. В лаборатории алкены получают по реакциям отщепления (элиминирования), при которых от соседних атомов углерода отщепляются два атома или две группы атомов и образуется дополнительная π – связь.
а) дегидратация спиртов происходит при их нагревании с водоотнимающими средствами (Н2SO4 или Н3РО4) при температуре выше 150 0С.
СН3―СН2―ОН 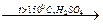 СН2=СН2 + Н2О.
СН2=СН2 + Н2О.
б) отщепление галогеноводородов проводят при действии спиртовых растворов щелочей на галогеналканы:
СН3―СН2― СНBr―СН3 + КОН 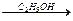
СН3―СН=СН―СН3 + КBr +Н2О.
При отщеплении Н2О от спиртов, НBr и НСl от галогеналканов атом водорода преимущественно отщепляется от наименее гидрированного атома углерода. Эта закономерность носит название правила Зайцева.
в) дегалогенирование дигалогенидов осуществляют при нагревании с активными металлами:
СН2Br― СНBr―СН3 +Mg  СН2=СН―СН3 + MgBr2.
СН2=СН―СН3 + MgBr2.
Физические свойства. При обычных условиях С2 – С4 – газы, С5 – С15 – жидкости, С16 – твердые вещества. Алкены имеют несколько более низкие температуры плавления и кипения, чем соответствующие им алканы. Алкены не растворяются в Н2О, хорошо растворимы в органических растворителях.
Химические свойства алкенов определяются наличием в их молекулах двойной связи. Электронная плотность 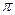 -связи достаточно подвижна и легко вступает в реакции с электрофильными частицами. Поэтому многие реакции алкенов протекают по механизму электрофильного присоединения. Упрощенно схему реакции присоединения можно представить следующим образом:
-связи достаточно подвижна и легко вступает в реакции с электрофильными частицами. Поэтому многие реакции алкенов протекают по механизму электрофильного присоединения. Упрощенно схему реакции присоединения можно представить следующим образом:
 |  | ||||||
 |  | ||||||
 С=С + А―В →
С=С + А―В → 
 С―С .
С―С .
| |
А В
1. Реакции присоединения.
а) гидрирование производится при комнатной температуре на катализаторах Ni, Pt, Pd.
СН2=СН2 + Н2 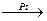 СН3―СН3.
СН3―СН3.
б) галогенирование. Алкены обесцвечивают бромную воду: СН2=СН2 + Br2→ СН2Br―СН2Br.
Эта реакция является качественной на непредельные углеводороды.
в) гидрогалогенирование (присоединение галогеноводородов): СН2=СН2 + НBr → СН3―СН2Br.
бромистый этил
К гомологам этилена галогеноводороды присоединяются в соответствии с правилом Марковникова: атом водорода присоединяется к наиболее гидрированному атому углерода, а атом галогена – к наименее гидрированному:
СН3―СН=СН2 + НВr → СН3―СН―СН3.
|
Br
2 - бромпропан
г) гидратация. Взаимодействие алкенов с водой происходит в присутствии минеральных кислот (Н2SO4, H3PO4), выполняющих роль катализаторов. Присоединение воды идет также по правилу Марковникова:
СН3―СН=СН2 +НОН→ СН3―СН―СН3;
|
ОН
Пропанол – 2
СН2=СН2 + НОН 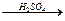 СН3―СН2ОН.
СН3―СН2ОН.
Этиловый спирт
Данная реакция в присутствии твердых катализаторов используется для получения этилового спирта из непредельных углеводородов, содержащихся в продуктах крекинга нефти, попутных газах, коксовых газах.
д) полимеризация алкенов и их производных в присутствии кислот протекает по механизму электрофильного присоединения.
nСН2=СН2 → (―СН2―СН2―)n .
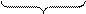 мономер
мономер
элементарное звено (структурная единица)
Исходное вещество, вступающее в реакцию полимеризации, называется мономером, продукт реакции называется полимером. Полимер – вещество с большой молекулярной массой, молекула которого состоит из большого числа повторяющихся группировок, имеющих одинаковое строение. Эти группировки называются элементарными звеньями или структурными единицами.
Число элементарных звеньев n – степень полимеризации.
2. Реакции окисления.
а) при мягком окислении алкенов водным раствором КМnO4 (реакция Вагнера) образуются двухатомные спирты.
3СН2=СН2 + 2КМnO4 + 4Н2О→3СН2―СН2 +2MnO2↓ +2КОН.
| |
ОН ОН
В результате протекания этой реакции фиолетовый раствор перманганата калия обесцвечивается и выпадает коричневый осадок MnO2. Это также качественная реакция на двойную связь.
б) при жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв двойной связи с образованием кетонов, карбоновых кислот или СО2:
СН3―СН=СН―СН3 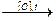 2СН3―СООН.
2СН3―СООН.
в) На серебряном катализаторе при 200 ºС алкены с кислородом образуют оксиды алкена.
 2СН2=СН2 + О2
2СН2=СН2 + О2 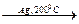 2СН2―СН2.
2СН2―СН2.
О
оксид этилена
г) горение. Как и все углеводороды, алкены горят с образованием СО2 и Н2О:
СnH2n + 3n/2O2→nCO2 + nH2O.
д) алкилирование. Реакция получения полистирола:

 СН2―СН3
СН2―СН3
СН2=СН2 + 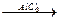 →
→
этилбензол



 СН=СН2 ―СН2―СН2―
СН=СН2 ―СН2―СН2―
 → →
→ →
n
стирол полистирол
Применение.
Этилен (С2Н4) – бесцветный газ со слабым запахом, мало растворим в Н2О, с воздухом образует взрывчатые смеси, горит коптящим пламенем.Является важнейшим сырьем в химической промышленности для получения этилового спирта, этиленгликоля, уксусного альдегида, полиэтилена.
Пропилен (С3Н6) – бесцветный газ со слабым запахом. Широко используется в органическом синтезе для получения изопропилового спирта, глицерина, ацетона, полипропилена.
Полиэтилен (―СН2―СН2―)n. В зависимости от количества звеньев n получают различные промышленные продукты. Полиэтилен с короткими цепями (n=20) является жидкостью, обладающей смазывающими свойствами. Полиэтилен с n=1500-2000 звеньев – твердый, но гибкий, пластичный материал, из которого получают пленку, посуду, бутылки, эластичные трубы и т. п. Полиэтилен с n=5-6 тысяч звеньев – твердое вещество, из которого изготавливают литые изделия – жесткие трубы и др.
Полипропилен (―СН2―СН2―)n используется для
|
СН3
производства волокон, емкостей, труб, деталей.
Дата добавления: 2018-11-26; просмотров: 1365;











