Кислородсодержащие органические соединения
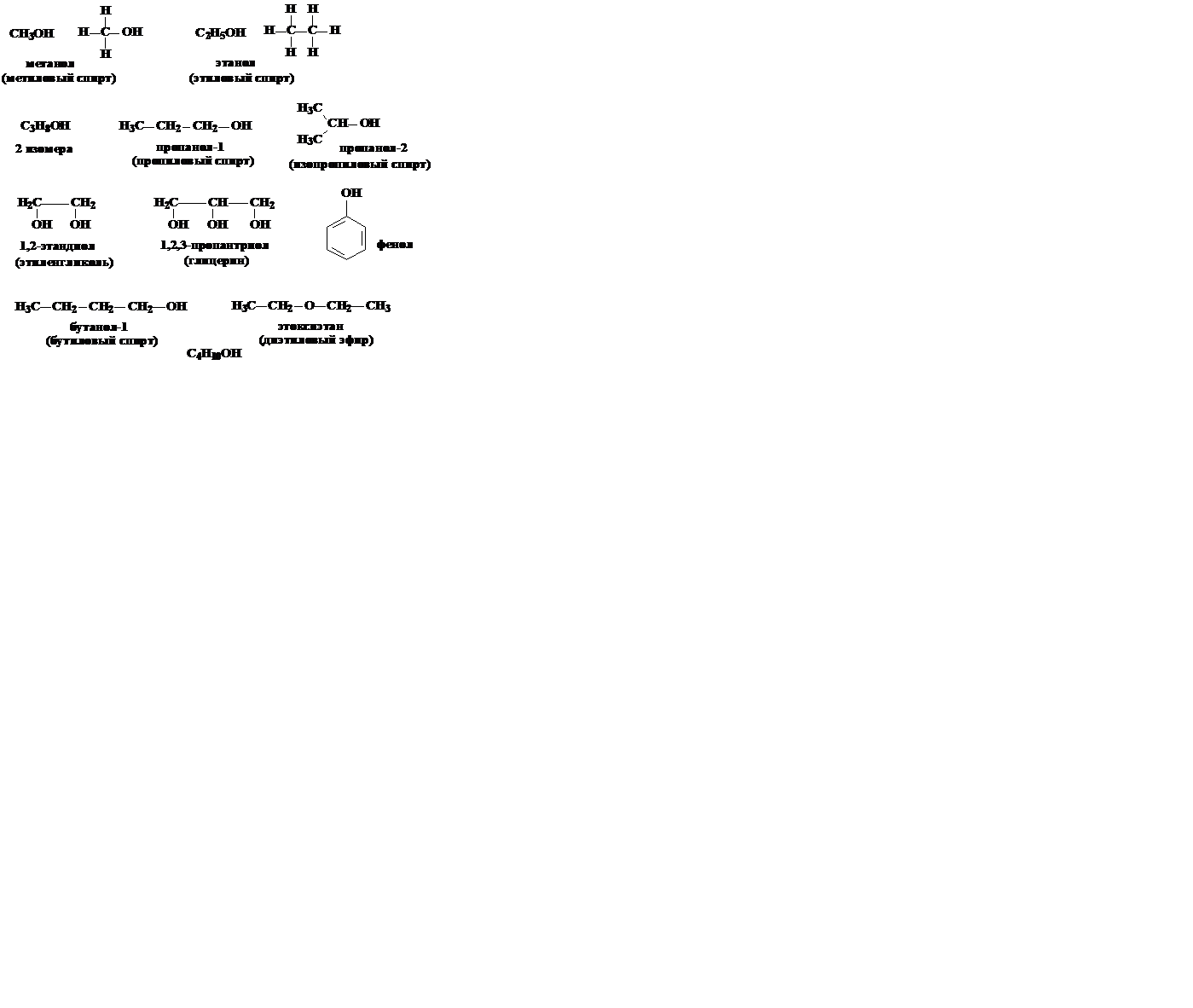
Основными классами кислородсодержащих органических соединений являются спирты, карбонильные соединения и карбоновые кислоты. 1. Спирты. Спиртами называют органические соединения, содержащие в своем составе функциональную группу ОН(гидроксильную группу), связанную с углеводородным радикалом. Таким образом, молекулу спирта можно представить как молекулу воды, в которой один атом водорода замещен на углеводородный заместитель. В соответствии с номенклатурой ИЮПАК название спирта образуется из названия углеводородного радикала + окончание -ол. Если число атомов углерода в молекуле больше двух, указывается, у какого атома находится гидроксильная группа (-ол-1, -ол-4). Если гидроксильных групп несколько, то указывается их количество (этандиол, пропантриол). Изомерами спиртов являются простые эфиры. В молекуле простого эфира атом кислорода с обоих сторон связан с углеводородными радикалами. Подобно молекулам воды, молекулы спиртов могут образовывать водородные связи друг с другом и с молекулами воды. Это обуславливает хорошую растворимость многих спиртов в воде и высокую температуру их кипения. В отличие от спиртов эфиры летучи, имеют значительно более низкие, по сравнению со спиртами, температуры кипения и плохо растворимы в воде.
Органические соединения, молекулы которых содержат карбонильную группу С=О, называются карбонильными. В зависимости от характера связанных с карбонильной группой заместителей различают альдегиды, кетоны, и их функциональные производные.
2. Альдегиды.Альдегидами называются органические соединения, содержащие карбонильную группу, в которой карбонильный атом углерода связан с одним углеводородным радикалом и одним атомом водорода. Исключение составляет только муравьиный альдегид, в котором оба заместителя – атомы водорода.

3. Кетоны.Кетонами называются органические соединения, которые содержат карбонильную группу, связанную с двумя углеводородными радикалами. В молекуле кетона радикалы могут быть одинаковыми или разными.
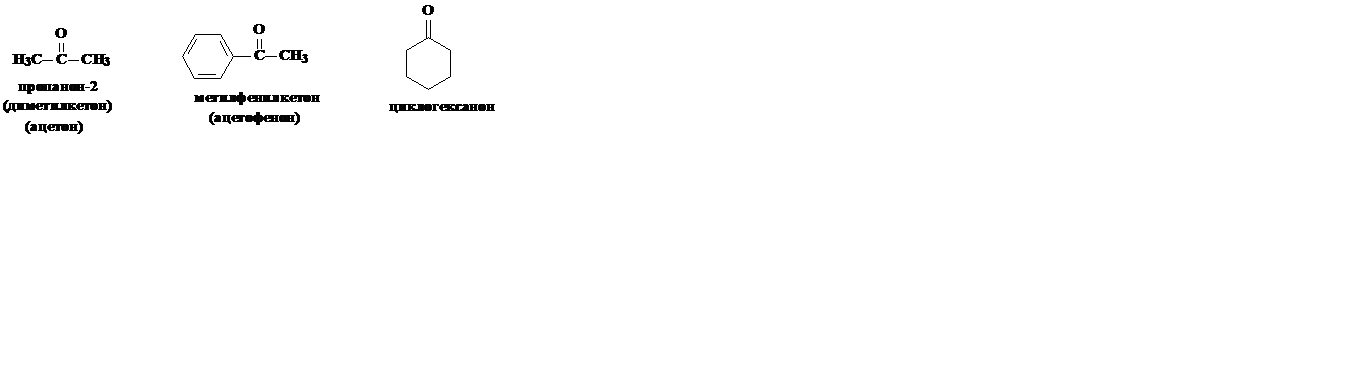
Для альдегидов часто используют тривиальные названия, соответствующие названиям кислот (с тем же числом углеродных атомов), в которые альдегиды переходят при окислении. По систематической номенклатуре названия альдегидов образуют прибавляя окончание -аль к названию родоначального углеводорода с самой длинной углеродной цепью, включающей карбонильную группу, от которой и начинают нумерацию цепи. Названия ароматических альдегидов производят от родоначальной структуры ряда - бензальдегида С6Н5—СН=0. Кетоны называют по наименованию радикалов, связанных с карбонильной группой, или по систематической номенклатуре: к названию предельного углеводорода добавляют суффикс-он и указывают номер атома углерода, связанного с карбонильным кислородом. Нумерацию начинают с ближайшего к кетонной группе конца цепи.
Изомерия альдегидов связана только со строением радикалов, которые могут иметь как нормальную (неразветвленную), так и разветвленную цепь.
Изомерия кетонов связана со строением радикалов и с положением карбонильной группы в углеродной цепи. Альдегиды и кетоны, имеющие одинаковую брутто-формулу, по отношению друг к другу являются межклассовыми изомерами.

4. Карбо́новые кислоты - класс органических соединений, молекулы которых содержат одну или несколько функциональных групп –COOH, которые называются карбоксильными. Карбоксильная группа сочетает в себе две функциональные группы - карбонильную C=O и гидроксильную O-H, взаимно влияющие друг на друга. Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим явлением дополнительной (по сравнению со спиртами) поляризации связи О-Н. Вследствие этого карбоксильная группа может сравнительно легко отщеплять протон. Анион R-COO− называется ацильным остатком.
R-COOH = R-COO− + H+
В зависимости от радикала, связанного с карбоксилом, различают алифатические (предельные и непредельные), алициклические, ароматические и
гетероциклические карбоновые кислоты. По числу карбоксильных групп кислоты могут быть одно-, двух- и многоосновными. При введении в молекулы кислоты других функциональных групп (например, -ОН, =CO, -NH2 и др.) образуются окси-, кето-, аминокислоты и другие классы соединений.

За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75×10−5. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.
Растворимость в воде и высокие температуры кипения карбоновых кислот обусловлены образованием межмолекулярных водородных связей. С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Гидроксильная группа в карбоновых кислотах может быть замещена на различные функциональные группы (O-R – сложные эфиры, NH2 – амиды, галогены – галогенангидриды).
Дата добавления: 2021-01-26; просмотров: 867;











