Бензол и его производные
Строение. Первая структура бензола была предложена в 1865 г. немецким ученым А. Кекуле.
Н
|

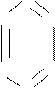 С
С
Н ―С С―Н
или
Н― С С―Н
С
|
Н
Эта формула правильно отражает равноценность шести атомов углерода, однако не объясняет ряд особых свойств бензола. Например, несмотря на ненасыщенность, бензол не проявляет склонности к реакциям присоединения: он не обесцвечивает бромную воду и раствор перманганата калия, то есть не дает типичных для непредельных соединений качественных реакций. Поэтому вопрос о строении бензола привлекал внимание исследователей на протяжении десятков лет.
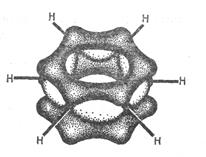
Особенности строения и свойств бензола удалось полностью объяснить только после развития современной квантовомеханической теории химических связей. По современным представлениям все шесть атомов углерода в молекуле бензола находятся в sp2 – гибридном состоянии. Каждый атом углерода образует 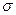 - связи с двумя другими атомами углерода и одним атомом водорода, лежащими в одной плоскости. Валентные углы между тремя связями равны 1200. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник (
- связи с двумя другими атомами углерода и одним атомом водорода, лежащими в одной плоскости. Валентные углы между тремя связями равны 1200. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник ( 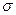 - скелет молекулы бензола) (рис. 8.1).
- скелет молекулы бензола) (рис. 8.1).
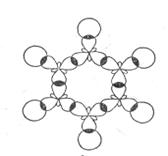
Рис. 8.1. σ – скелет молекулы бензола
Каждый атом углерода имеет одно негибридное р – облако. Шесть таких облаков располагаются перпендикулярно плоскому 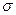 - скелету и параллельно друг другу (рис. 8.2, а). Все шесть р – орбиталей взаимодействуют между собой, образуя
- скелету и параллельно друг другу (рис. 8.2, а). Все шесть р – орбиталей взаимодействуют между собой, образуя 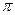 - связи, не локализованные в пары, как при образовании обычных двойных связей, а образуют единое
- связи, не локализованные в пары, как при образовании обычных двойных связей, а образуют единое 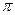 - электронное облако. Таким образом, в молекуле бензола осуществляется круговое сопряжение (ароматический секстет).
- электронное облако. Таким образом, в молекуле бензола осуществляется круговое сопряжение (ароматический секстет).
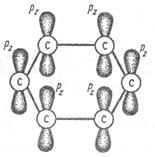
a б
Рис. 8.2. Электронное строение молекулы бензола а) негибридные р – орбитали атомов углерода; б) ароматическая
π – электронная система
Наибольшая 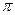 - электронная плотность в этой сопряженной системе располагается над и под плоскостью
- электронная плотность в этой сопряженной системе располагается над и под плоскостью 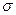 - скелета (рис. 8.2, б). В результате все связи между атомами углерода в бензоле выровнены и имеют длину 0,139 нм (рис. 8.3). Эта величина является промежуточной между длиной ординарной связи в алканах (0,154 нм) и длиной двойной связи в алкенах (0,133 нм). Равноценность связей принято изображать кружком внутри цикла (рис.8.3). Н
- скелета (рис. 8.2, б). В результате все связи между атомами углерода в бензоле выровнены и имеют длину 0,139 нм (рис. 8.3). Эта величина является промежуточной между длиной ординарной связи в алканах (0,154 нм) и длиной двойной связи в алкенах (0,133 нм). Равноценность связей принято изображать кружком внутри цикла (рис.8.3). Н
|
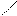 | |||||
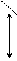 | |||||
 | |||||
|
|
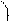 0,139 нм
0,139 нм
|
|
|
|
|

|
|




 0,108 нм
0,108 нм
Н
Рис. 8.3. Геометрическое строение молекулы бензола
Круговое сопряжение дает выигрыш в энергии 150 кДж/моль. Эта величина составляет энергию сопряжения - количество энергии, которую нужно затратить, чтобы нарушить ароматическую систему бензола.
Такое электронное строение объясняет все особенности бензола. В частности, понятно, почему бензол трудно вступает в реакции присоединения – это приводит к нарушению сопряжения. Такие реакции возможны только в очень жестких условиях.
Совокупность свойств бензола принято называть проявлением ароматического характера, или ароматичности.
Мы будем рассматривать гомологический ряд бензола с общей формулой СnH2n-6.
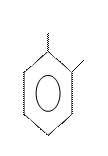
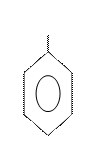
Изомерия и номенклатура.Структурная изомерия в ряду бензола обусловлена взаимным расположением заместителей в кольце. Если в бензольном кольце только один заместитель, то такое соединение не имеет ароматических изомеров, так как все атомы в бензольном ядре равноценны. Если с кольцом связаны два заместителя, то они могут находиться в трех разных положениях относительно друг друга. Положение заместителей указывают цифрами или обозначают словами
орто (о-), мета (м-), пара (п-):

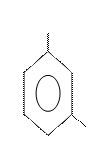
 Х X X
Х X X
Y
Y
Y
орто-изомер мета-изомер пара-изомер
(1,2 –) (1,3 –) (1,4 –)
При отщеплении атомов водорода от молекулы ароматических углеводородов образуются ароматические радикалы общей формулы СnH2n-7 (их называют арильными радикалами), простейшие из них – фенил и бензил:
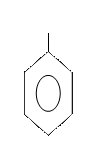 СН2―
СН2―
фенил бензил
 Название ароматические углеводороды происходит от слова «бензол» с указанием заместителей в бензольном кольце и их положения, например СН3
Название ароматические углеводороды происходит от слова «бензол» с указанием заместителей в бензольном кольце и их положения, например СН3
СН3
1,2 – диметилбензол
Получение.Арены содержатся в нефти и продуктах ее переработки, в продуктах коксохимического производства – каменноугольной смоле и коксовом газе.
1. В промышленности арены получают:
 а) из алифатических углеводородов в процессе ароматизации (риформинга) предельных углеводородов, входящих в состав нефти:
а) из алифатических углеводородов в процессе ароматизации (риформинга) предельных углеводородов, входящих в состав нефти:
СН3
СН3
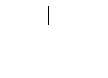 СН2
СН2

 Н2С СН2
Н2С СН2
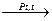 + 4Н2.
+ 4Н2.
Н2С СН2
СН2
гептан толуол
Из гексана таким образом получают бензол.
б) дегидрированием циклоалканов:


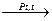 + 3Н2.
+ 3Н2.
в) Бензол получают при тримеризации ацетилена.

3СН ≡ СН 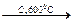
Реакция происходит при пропускании ацетилена над активированным углем при 600 0С.
г) Гомологи бензола получают реакцией взаимодействия бензола с галогеналканами в присутствии галогенидов алюминия (реакция Фриделя-Крафтса):
 R
R

+ RCl 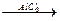 + HCl.
+ HCl.
2. В лаборатории арены получают при сплавлении ароматических солей со щелочью:
С6Н5СООNa + NaOH 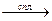 Na2CO3 + C6H6↑.
Na2CO3 + C6H6↑.
Физические свойства.Первые члены гомологического ряда бензола – бесцветные жидкости со специфическим запахом. Они легче воды и в ней не растворимы. Хорошо растворяются в органических растворителях и являются хорошими растворителями для многих органических веществ. Бензол ядовит, другие арены менее опасны. Работа с бензолом (и его гомологами) требует особой осторожности.
Химические свойства. Для аренов наиболее характерны реакции, протекающие по механизму электрофильного замещения, так как при этом сохраняется их ароматическая система.
1. Галогенирование осуществляется в присутствии катализаторов FeBr3, AlCl3, FeCl3.
 Br
Br
C6H6 + Br2  + HBr.
+ HBr.
 Cl
Cl
C6H6 + Cl2 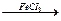 + HCl.
+ HCl.
2. Нитрование. Бензол очень медленно реагирует с концентрированной НNO3 даже при сильном нагревании. Однако при действии нитрующей смеси (смесь концентрированных азотной и серной кислот) реакция нитрования проходит достаточно легко:
C6H6 + НОNO2 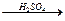 C6H5NO2 + H2O.
C6H5NO2 + H2O.
3. Сульфирование. Реакция легко проходит под действием «дымящей» серной кислоты (олеума).
C6H6 + Н2SO4 → C6H5SO3H + H2O.
4. Алкилирование по Фриделю-Кравтсу:
C6H6 + СН3Вr 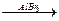 C6H5CH3 + HBr.
C6H5CH3 + HBr.
метилбензол
(толуол)
 5. Алкилирование алкенами. Эти реакции широко используются в промышленности для получения этилбензола и изопропилбензола (кумола). Алкилирование проводят в присутствии катализатора AlCl3:
5. Алкилирование алкенами. Эти реакции широко используются в промышленности для получения этилбензола и изопропилбензола (кумола). Алкилирование проводят в присутствии катализатора AlCl3:
C6H6 + СН2=СН―СН3 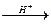 C6H5―СН(СН3)2.
C6H5―СН(СН3)2.
изопропилбензол (кумол)
 СН3―СН―СН3
СН3―СН―СН3
Структурная формула
изопропилбензола:
Наряду с реакциями замещения ароматические углеводороды могут вступать в реакции присоединения, однако эти реакции приводят к разрушению ароматической системы и поэтому требуют больших затрат энергии, протекают в жестких условиях.

 1. Гидрирование бензола идет при нагревании и высоком давлении в присутствии катализаторов Ni, Pt, Pd.
1. Гидрирование бензола идет при нагревании и высоком давлении в присутствии катализаторов Ni, Pt, Pd.
+ 3Н2 →
циклогексан
Гомологи бензола при гидрировании дают производные циклогексана:
С6Н5СН3 + 3Н2 → С7Н14.
2. Присоединение хлора к молекуле бензола происходит при взаимодействии его паров с хлором под воздействием жесткого ультрафиолетового излучения.
С6Н6 + 3Сl2 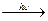 С6Н6Cl6.
С6Н6Cl6.
гексахлорциклогексан
(гексахлоран)
3. Бензол горит ярким коптящим пламенем.
С6Н6 + 15/2О2 → 6СО2 + 3Н2О.
Применение.Бензол используется в химической промышленности как растворитель и сырье для производства стирола, фенола, анилина, красителей, лекарственных препаратов.
Толуол используется как сырье в производстве лаков, типографских красок, бензойной кислоты, взрывчатых веществ, лекарственных препаратов, как добавка к моторному топливу для повышения октанового числа бензинов.
Стирол используется в производстве полистирола, синтетического каучука.
Дата добавления: 2018-11-26; просмотров: 1704;











