Классификация органических реакций
1. По типу разрыва химических связей в реагирующих частицах реакции подразделяют на два типа: радикальные и ионные.
Радикальные реакции – это процессы, идущие с гомолитическим разрывом ковалентной связи. При этом пара электронов, образующая связь, делится таким образом, что каждая из образующихся частиц получает по одному электрону. В результате гомолитического разрыва образуются свободные радикалы.
X:Y → X· + ·Y.
Нейтральный атом или частица с неспаренным электроном называется свободным радикалом.
Ионные реакции – это процессы, идущие с гетеролитическим разрывом ковалентных связей, когда оба электрона связи остаются с одной из ранее связанных частиц.
X :Y → X+ + :Y.-
В результате гетеролитического разрыва связи получаются заряженные частицы: нуклеофильная и электрофильная.
Нуклеофильная частица (нуклеофил) – это частица, имеющая пару электронов на внешнем энергетическом уровне. За счет пары электронов нуклеофил способен образовывать новую ковалентную связь.
Электрофильная частица (электрофил) – это частица, имеющая свободную орбиталь на внешнем энергетическом уровне. Электрофил предоставляет незаполненные, вакантные орбитали для образования ковалентной связи.
2. По структурному признаку органические реакции подразделяют на следующие типы:
1) реакции присоединения:
RCH=CH2 + XY→RCHX―CH2Y;
2) реакции замещения:
RCH2X + Y→RCH2Y + X;
3) реакции отщепления (элиминирования):
R―CHX―CH2Y→R―CH=CH2 +XY;
4) реакции полимеризации:
nCH2=CH2 → (―CH2―CH2―)n.
Примеры: 1) СН2=СН2 + HCl → CH3―CH2CI;
2) CH4 + CI2 → CH3CI + HCI;
3) CH3―CH2Br → CH2=CH2 +HBr.
Особый тип составляют реакции поликонденсации.
3. В зависимости от химической природы реакции подразделяются на следующие виды:
1. Реакции окисления – процессы, при которых под действием окисляющего реагента вещество соединяется с кислородом (либо другим электроотрицательным элементом) или теряет водород (в виде воды или молекулярного водорода):
СН3СНО 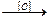 CH3COOH;
CH3COOH;
CH3OH 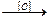 CH2O + H2O;
CH2O + H2O;
CH3OH 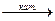 CH2O + H2 .
CH2O + H2 .
Отщепление водорода в последнем примере называется дегидрированием и проводится в присутствии катализатора.
2. Реакции восстановления – реакции, обратные окислению. Под действием восстанавливающего реагента соединение принимает атомы водорода или теряет атомы кислорода:
СН3СОСН3 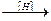 СН3СНОНСН3.
СН3СНОНСН3.
3. Реакция гидрирования – реакция, представляющая собой частный случай восстановления. Водород присоединяется к кратной связи или ароматическому ядру в присутствии катализатора.
4. Реакция конденсации – реакция, при которой происходит рост цепи. Сначала происходит присоединение, за которым обычно следует элиминирование.
5. Пиролиз – реакция, при которой соединение подвергается термическому разложению без доступа воздуха с образованием одного или нескольких продуктов. Иногда вместо пиролиза употребляется термин «сухая перегонка».
Дата добавления: 2018-11-26; просмотров: 853;











