ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
К предельным углеводородам относятся алканы и циклоалканы.
Алканы (парафины)
Алканы являются насыщенными, или предельными, углеводородами, поскольку все свободные валентности атомов углерода заняты атомами водорода. Простейшим представителем алканов является метан СН4. Начиная с него, можно построить ряд, в котором каждый последующий углеводород отличается от предыдущего на гомологическую разность СН2. Общая формула гомологического ряда алканов СnH2n+2.
Простейшие представители ряда:
СН4 СН3―СН3 СН3―СН2―СН3
метан этан пропан
СН3―СН2―СН2―СН3 СН3―(СН2)3―СН3
бутан пентан
Названия алканов содержат суффикс – ан.
Каждый атом углерода в алканах находится в состоянии sp3 – гибридизации и образует четыре σ – связи, углы между которыми 109,5°. Длина связи С―С в алканах равна 0,154 нм.
В случае метана у возбужденного атома углерода на втором энергетическом уровне четыре неспаренных электрона
С* n = 2 
При образовании ковалентной связи происходит sp3- гибридизация. Гибридизация – это выравнивание взаимодействующих орбиталей разных подуровней по форме и энергии.
В молекуле метана атом углерода находится в тетраэдрическом окружении четырех атомов водорода (рисунок); в ней формируются четыре σ-связи С – Н.
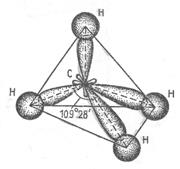
Образование четырех σ – связей sp3 - гибридными орбиталями атома углерода в молекуле метана
Изомерия.Основу молекул алканов составляет углеродный скелет, который может принимать самые разные геометрические формы при сохранении длин связей и углов между связями. Например, углеродная цепь пентана С5Н12 может выглядеть следующим образом:
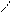
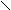
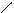

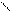
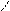
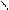
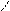 С С С С
С С С С
 С С С С С С С
С С С С С С С
 С―С С
С―С С
С
Данные положения углеродной цепи называются конформациями. При обычных температурах разные конформации алканов свободно переходят друг в друга путем вращения С―С связей, поэтому очень часто конформации называют поворотными изомерами.
Основной вид изомерии для алканов – изомерия углеродного скелета. Начиная с бутана С4Н10, одной и той же молекулярной формуле отвечает несколько алканов, различающихся строением углеродного скелета. Число возможных изомеров СnH2n+2 резко увеличивается с ростом n.
Для бутана известны 2 изомера, для пентана (С5Н12) - 3, для гексана (С6Н14) - 5, для гептана (С7Н16) - 9, для октана (С8Н18) - 18, для нонана (Н9Н20) - 35, для эйкозана (С20Н42) – 36319. Для каждого n существует единственный изомер с неразветвленной цепью, он называется нормальным.
Если у молекул алканов отнять один атом водорода, то получаются углеводородные радикалы с одной свободной валентностью. Общая формула предельных углеводородных радикалов СnH2n+1. Простейшие радикалы:
СН3―; СН3―СН2―; СН3―СН2―СН2―; СН3―СН―СН3.
метил этил пропил |
изопропил
Начиная с С3Н7 для радикалов возможна структурная изомерия, связанная со строением углеродного скелета или с положением свободной валентности. Так, два радикала С3Н7 – (пропил и изопропил) имеют одинаковую формулу, но свободная валентность в пропиле находится у первичного атома углерода, а в изопропиле – у вторичного.
Названия нормальных алканов по международной
(заместительной) номенклатуре
| Строение | Число атомов углерода | Название |
| СН4 | метан | |
| СН3СН3 | этан | |
| СН3СН2СН3 | пропан | |
| СН3(СН2)2СН3 | бутан | |
| СН3 (СН2)3СН3 | пентан | |
| СН3(СН2)4СН3 | гексан | |
| СН3(СН2)5СН3 | гептан | |
| СН3(СН2)6СН3 | октан | |
| СН3(СН2)7СН3 | нонан | |
| СН3(СН2)8СН3 | декан |
Атом углерода, который связан только с одним атомом углерода в цепи, называется первичным, с двумя – вторичным, с тремя – третичным, с четырьмя - четвертичным.
Номенклатура.По международной (заместительной) номенклатуре ИЮПАК первым четырем членам гомологического ряда алканов присвоены их исторически сложившиеся названия. Названия остальных алканов с нормальной углеродной цепью составляются из греческого названия числительного, соответствующего числу атомов углерода в цепи, с добавлением суффикса –ан.
Алканы с разветвленной цепью, рассматриваются, как производные нормального алкана, в котором один или несколько атомов водорода замещены на углеводородные радикалы. Для этого выбирают главную углеродную цепь, которая содержит наибольшее число атомов углерода и составляет основу названия. Главную цепь нумеруют с того конца, ближе к которому находится заместитель. Перед основой названия указывают номер атома углерода, при котором находится заместитель, и название этого заместителя, например
1 2 3 4 5 6
СН3―СН―СН2―СН―СН2―СН3.
| |
СН3 С2Н5
2 – метил – 4 - этилгексан
Способы получения. Основные природные источники алканов – нефть и природный газ. Кроме того, метан выделяется со дна болот (болотный газ), каменноугольных шахт (рудничный газ).
Синтетические методы получения алканов:
1. Гидрогенизация бурых углей, оксида углерода, алкенов и алкинов в присутствии катализаторов при повышенных температурах и давлении:
С + 2Н2 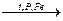 СН4;
СН4;
СО + 3Н2 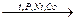 СН4 + Н2О;
СН4 + Н2О;
СnН2n + H2 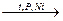 CnH2n+2;
CnH2n+2;
CnH2n-2 +2H2 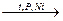 CnH2n+2.
CnH2n+2.
2. В лаборатории алканы получают:
а) сплавлением карбоновых кислот со щелочами:
R―COONa + NaOH → R―H + Na2CO3;
б) гидратацией карбида алюминия:
Al4C3 + 12H2O → 3CH4↑ + 4Al(OH)3;
в) синтезом Вюрца:
2R―Hal + 2Na → R―R + 2NaHal.
Физические свойства.Алканы с числом атомов углерода (н.у.) от 1 до 4 – газы, от 5 до 16 – жидкости, свыше 16 - твердые вещества.
В гомологическом ряду алканов температуры плавления и кипения возрастают.
Разность в температурах кипения между алканами с n=1 и n=2 равна 73 ºС, а между алканами с n=9 и n=10 равна 25 ºС, поэтому высшие алканы разделить перегонкой труднее, чем низшие.
Алканы легче воды и не растворяются в ней, но растворяются в органических растворителях (этиловый спирт, диэтиловый эфир). Жидкие алканы хорошо смешиваются друг с другом.
Химические свойства.Алканы обладают сравнительно низкой химической активностью, поэтому их называют еще парафинами (имеющими малое сродство).
1. Благодаря гомолитическому расщеплению ковалентных связей С―Н алканы способны вступать в реакции замещения.
а) галогенирование. При взаимодействии с хлором и бромом под действием УФ – излучения или высокой температуры происходит реакция по схеме
СН4 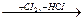 СН3СI
СН3СI 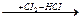 CH2CI2
CH2CI2
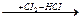 CHCI3
CHCI3 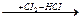 CCI4.
CCI4.
На самом деле эта реакция протекает по цепному механизму.
б) нитрование (реакция Коновалова). При действии разбавленной азотной кислоты на алканы при 140 ºС и небольшом давлении протекает радикальная реакция:
СН3—СН3 + НNО3 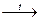 CH3—CH2—NO2 + H2O.
CH3—CH2—NO2 + H2O.
При радикальных реакциях (галогенирование, нитрование) в первую очередь замещается атом водорода у третичных, затем у вторичных и первичных атомов углерода. Это объясняется тем, что легче всего разрывается гомолитическая связь третичного атома углерода с водородом (Есв=376 кДж/моль), затем – вторичного (390 кДж/моль) и только потом - первичного (415 кДж/моль).
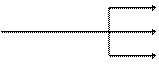
2. Реакция изомеризации. Нормальные алканы при нормальных условиях могут превращатьсяв алканы с разветвленной цепью:СН3—СН2—СН2—СН3 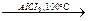 СН3—СН—СН3.
СН3—СН—СН3.
|
СН3
3. Крекинг – это гомолитический разрыв связей С—С, который протекает при нагревании под действием катализаторов. При крекинге высших алканов образуются алкены и низшие алканы, при крекинге метана и этана образуется ацетилен:
С8Н18→С4Н10 +С4Н8;
2СН4→С2Н2 + 3Н2;
С2Н6→С2Н2 +2Н2.
Эти реакции имеют большое промышленное значение, таким путем высококипящие фракции нефти (мазут) превращают в бензин, керосин и другие ценные продукты.
 4. Окисление. При мягком окислении метана кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота: СН3ОН
4. Окисление. При мягком окислении метана кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота: СН3ОН
|
|
200 ºС
НСООН.
Мягкое окисление бутана кислородом воздуха в присутствии катализатора – один из промышленных способов получения уксусной кислоты.
2С4Н10 + 5О2 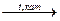 4СН3СООН + 2Н2О.
4СН3СООН + 2Н2О.
На воздухе алканы сгорают с образованием СО2 и Н2О:
СnH2n+2 + (3n+1)/2O2→nCO2 + (n + 1)H2O.
Горение метана в зависимости от доступа воздуха происходит по-разному: обильный доступ СН4 + 2О2→СО2 + 2Н2О;
ограниченный доступ 2СН4 + 3О2→2СО + 4Н2О;
очень ограниченный доступ СН4 + О2→С + 2Н2О.
Применение.Метан (СН4) – бесцветный газ без запаха, малорастворимый в Н2О, основной компонент природного газа. Метан используется в качестве промышленного и бытового топлива, является сырьем для получения сажи, ацетилена, хлороформа, метилового спирта и др.
Этан (С2Н6) – бесцветный газ без запаха. Добывают его из нефтяных скважин. Применяется в качестве сырья в синтезе этилена.
Пропан (С3Н8), бутан (С4Н10) – бесцветные газы без запаха, легко сжижаются, являются основными компонентами транспортируемого в баллонах сжиженного газа, используются в качестве сырья в химической промышленности для получения бутадиена, пропилена.
Вазелиновое масло – смесь алканов с n<15, бесцветная маслянистая жидкость без запаха и вкуса, не растворимая в Н2О. Используется в медицине, фармацевтической промышленности и парфюмерии.
Вазелин – смесь жидких и твердых алканов с n=12 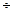 25, бесцветное или светло-желтое однородное вещество, не растворимое в Н2О. Используется в фармацевтической промышленности как основа для приготовления мазей.
25, бесцветное или светло-желтое однородное вещество, не растворимое в Н2О. Используется в фармацевтической промышленности как основа для приготовления мазей.
Парафин – смесь длинноцепочечных углеводородов с n=19 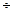 35, белое твердое мелкокристаллическое вещество без запаха и вкуса, не растворимое в Н2О, tпл.=50-57 °С. Используется в фармации как основа для мазей, в медицине для лечения теплом, а также как сырьё в химической промышленности.
35, белое твердое мелкокристаллическое вещество без запаха и вкуса, не растворимое в Н2О, tпл.=50-57 °С. Используется в фармации как основа для мазей, в медицине для лечения теплом, а также как сырьё в химической промышленности.
Озокерит (горный воск) – ископаемое вещество нефтяного происхождения, смесь высших алканов и алкенов, смол и минеральных масел, твердая воскоподобная масса, используется в медицине для лечения теплом.
Дата добавления: 2018-11-26; просмотров: 1274;











