Скорость реакции и равновесие
Пусть есть обратимая реакция A + B  C + D. Если предположить, что прямая и обратная реакция проходят в одну стадию, то скорости этих реакций будут прямо пропорциональны концентрациям реагентов: скорость прямой реакции v1 = k1[A][B], скорость обратной реакции v2 = k2[C][D] (квадратными скобками обозначены молярные концентрации реагентов). Видно, что по мере протекания прямой реакции концентрации исходных веществ А и В снижаются, соответственно, уменьшается и скорость прямой реакции. Скорость же обратной реакции, которая в начальный момент равна нулю (нет продуктов C и D), постепенно увеличивается. Рано или поздно наступит момент, когда скорости прямой и обратной реакций сравняются. После этого концентрации всех веществ – А, В, С и D не изменяются со временем. Это значит, что реакция достигла положения равновесия, а неизменяющиеся со временем концентрации веществ называются равновесными. Но, в отличие от механического равновесия, при котором всякое движение прекращается, при химическом равновесии обе реакции – и прямая, и обратная – продолжают идти, однако их скорости равны и поэтому кажется, что никаких изменений в системе не происходит (Рис. 7.10.).
C + D. Если предположить, что прямая и обратная реакция проходят в одну стадию, то скорости этих реакций будут прямо пропорциональны концентрациям реагентов: скорость прямой реакции v1 = k1[A][B], скорость обратной реакции v2 = k2[C][D] (квадратными скобками обозначены молярные концентрации реагентов). Видно, что по мере протекания прямой реакции концентрации исходных веществ А и В снижаются, соответственно, уменьшается и скорость прямой реакции. Скорость же обратной реакции, которая в начальный момент равна нулю (нет продуктов C и D), постепенно увеличивается. Рано или поздно наступит момент, когда скорости прямой и обратной реакций сравняются. После этого концентрации всех веществ – А, В, С и D не изменяются со временем. Это значит, что реакция достигла положения равновесия, а неизменяющиеся со временем концентрации веществ называются равновесными. Но, в отличие от механического равновесия, при котором всякое движение прекращается, при химическом равновесии обе реакции – и прямая, и обратная – продолжают идти, однако их скорости равны и поэтому кажется, что никаких изменений в системе не происходит (Рис. 7.10.).
Равновесными бывают не только химические реакции между газами или растворами, но и процессы растворения металлов, осадков. Например, твердое вещество быстрее всего растворяется, если его поместить в чистый растворитель, когда система далека от равновесия, в данном случае – от насыщенного раствора. Постепенно скорость растворения снижается, и одновременно увеличивается скорость обратного процесса – перехода вещества из раствора в кристаллический осадок. Когда раствор становится насыщенным, система достигает состояния равновесия, при этом скорости растворения и кристаллизации равны, а масса осадка со временем не меняется.
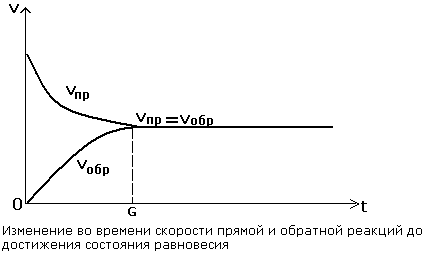
Рис.7.10.
Дата добавления: 2021-03-18; просмотров: 442;











