Экспериментальные методы определения констант скорости химической реакции
Реакции первого порядка.Примером такой реакции являются реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
H2S → H2 + S
Для реакций первого порядка кинетическое уравнение имеет следующий вид:
V = 

Роль концентрации при радиоактивном распаде играет количество радиоактивных атомов N. Заменив в предыдущем уравнении концентрацию на количество атомов и перенеся члены уравнения, включающие N, влево, время — вправо (эта операция называется разделением переменных), получим:

Интегрируя полученное уравнение по времени от 0 до t и по числу атомов от N0 до Ntполучим:

Потенцируя это уравнение, получим:
Nt = Nо ּe-kt
Уравнение Аррениуса, записанное через разность логарифмов, представляет уравнение прямой в координатах 1n N — время. В общем случае для реакции первого порядка выполняется аналогичная зависимость ln С — t. Построив соответствующий график (Рис.7.6), определим значение константы скорости для реакции первого порядка, как тангенс угла наклона прямой.
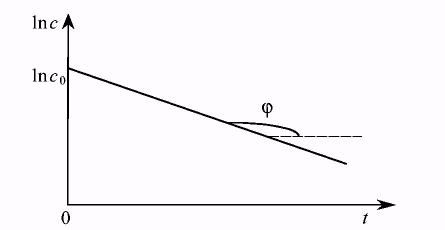
Рис. 7.6. Определение константы скорости реакции первого порядка.
Реакции второго порядка.Реакция димеризации ацетилена
2 С2Н2 =С4Н4
является реакцией второго порядка. Кинетическое уравнение этой реакции имеет следующий вид:

Проведя разделение переменных и проинтегрировав обе части уравнения в тех же пределах, что и в уравнении реакции первого порядка, получим

Если ввести следующие обозначения: у =1/Ct ; х = t; А =k; В =1/C0,
то уравнение представляет собой уравнение прямой у = А • х + В. Отложив по оси ординат 1/C, а по оси абсцисс время, и построив экспериментальную прямую (рис.7.7), аналогичную прямой, приведенной на рис. 7.6, найдем значение константы скорости для реакции второго порядка, как тангенс угла ее наклона. Наклон построенной прямой будет противоположен наклону прямой на рис. 7.6, так как при уменьшении концентрации со временем обратная ей величина возрастает. 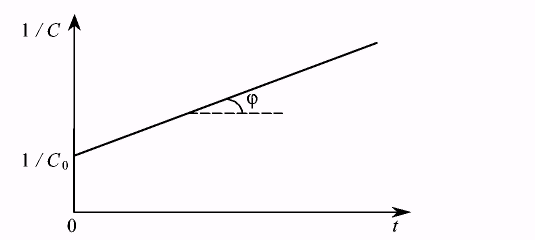
Рис. 7.7. Определение константы скорости реакции второго порядка.
Для рассмотрения реакции третьего порядка можно получить соответствующие соотношения, используя приведенный выше подход.
Из рис. 7.8, на котором приведены зависимости изменения концентрации от времени протекания реакции для различных порядков, видно, что наиболее резко концентрация вещества меняется со временем в реакции первого порядка, более медленно в реакции 2-го порядка и т.д. Здесь принимается, что значения констант скорости для всех порядков численно равны.
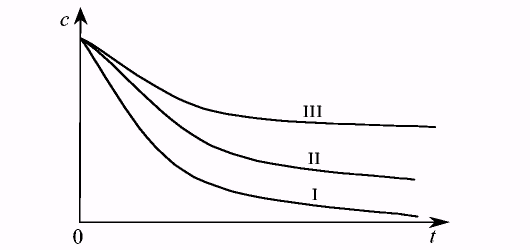
Рис. 7.8. Изменение концентрации реагента в реакциях первого -третьего порядков в зависимости от времени протекания реакции.
Размерность константы скорости.В зависимости от порядка реакции меняется и размерность константы скорости. Для реакции I-го порядка, подставив размерность скорости и концентрации в соответствующее уравнение, получим:

отсюда

По аналогии, для константы скорости реакции второго порядка, имеем:


откуда получаем:

7. 4 Сложные реакции 
Реакции, протекающие в одну стадию, называют простыми (элементарными) реакциями, а реакции, включающие несколько стадий - сложными. Энергетическая диаграмма простой реакции приведена на рис. 7.9 (а), сложной (двухстадийной) - на рис. 7.9 (б).
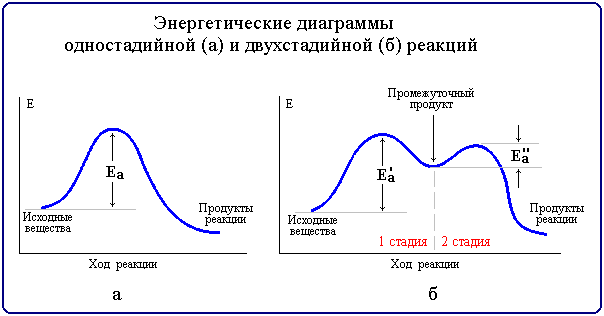
Рис. 7.9. Энергетические диаграммы
Так, например, многие органические реакции являются сложными и идут в несколько элементарных стадий (последовательных или параллельных). Общая скорость сложной химической реакции определяется скоростью ее наиболее медленной (лимитирующей) стадии. Например, в приведенной на рис. 7.9(б) диаграмме лимитирующей является стадия 1 с более высокой энергией активации Еа'. К кинетически сложным реакциям относят такжепоследовательные, параллельные, сопряженные, цепные, фотохимические и некоторые другие.
Фотохимические реакции 
Реакции, протекающие под воздействием светового излучения, называются фотохимическими, а раздел, изучающий фотохимические превращения, – фотохимией.
Основной закон фотохимии – закон квантовой эквивалентности (А. Эйнштейн, 1912 г): каждый поглощенный квант света hν вызывает изменение одной молекулы.
Важнейшим параметром фотохимической реакции служит квантовый выход γ:
|
В зависимости от типа фотохимической реакции квантовый выход может меняться в широких пределах. Это связано с возможностью потери поглощенной энергии до фотопревращения. Если время существования фотовозбужденной молекулы и скорость фотодиссоциации совпадают, то γ ~ 1. При γ >> 1 фотореакция идет по цепному механизму. В частности для реакции H2 + Cl2 = 2HCl γ = 105.
Типы фотохимических реакций:
1. Фотодиссоциация (фотолиз) приводит к разложению исходного вещества, поглотившего световую энергию. Примерами реакции фоторазложения служат такие: разложение галогенидов серебра (основа серебряной фотографии), фотолиз паров ацетона CH3CO CH3 → CO + другие продукты.
2. Фотосинтез приводит к образованию более сложных соединений. Примерами реакций фотосинтеза служат:
· фотосинтез озона в верхних слоях атмосферы, создающий защитный озоновый слой:
фотодиссоциация: 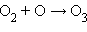
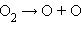
| ||
| Фотосинтез: |
· фотосинтез органических соединений из углекислого газа, воды, минеральных веществ зелеными растениями. В частности, синтез глюкозы может быть описан уравнением:
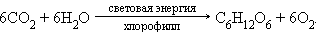
|
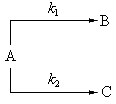
Последовательные реакции 
Последовательными называют реакции с промежуточными стадиями, когда продукт предыдущей стадии служит исходным веществом для последующей:

|
Например, последовательный гидролиз карбоксильных групп диалкилоксалатов:
AlkylO2C-CO2Alkyl + H2O → AlkylO2C-CO2H + H2O → HO2C-CO2H
Параллельные реакции 
Реакции, в которых исходные вещества способны образовывать разные продукты реакции или одно вещество одновременно способно реагировать с несколькими веществами, называются параллельными.
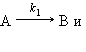
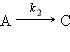
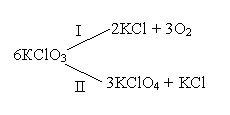
Например, при нагревании хлората калия одновременно могут протекать реакция разложения (I) и диспропорционирования (II):
Дата добавления: 2021-03-18; просмотров: 512;












