Константа равновесия.
Важнейший параметр, характеризующий обратимую химическую реакцию – константа равновесия К. Если записать для рассмотренной обратимой реакции A + D 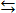 C + D условие равенства скоростей прямой и обратной реакции в состоянии равновесия – k1[A]равн[B]равн = k2[C]равн[D]равн, откуда [C]равн[D]равн/[A]равн[B]равн = k1/k2 = К, то величина К называется константой равновесия химической реакции. При равновесии отношение концентрации продуктов реакции к произведению концентрации реагентов постоянно, если постоянна температура (константы скорости k1 и k2 и, следовательно, константа равновесия К зависят от температуры, но не зависят от концентрации реагентов). Если в реакции участвуют несколько молекул исходных веществ и образуется несколько молекул продукта (или продуктов), концентрации веществ в выражении для константы равновесия возводятся в степени, соответствующие их стехиометрическим коэффициентам. Так для реакции 3H2 + N2 =2NH3 выражение для константы равновесия записывается в виде:
C + D условие равенства скоростей прямой и обратной реакции в состоянии равновесия – k1[A]равн[B]равн = k2[C]равн[D]равн, откуда [C]равн[D]равн/[A]равн[B]равн = k1/k2 = К, то величина К называется константой равновесия химической реакции. При равновесии отношение концентрации продуктов реакции к произведению концентрации реагентов постоянно, если постоянна температура (константы скорости k1 и k2 и, следовательно, константа равновесия К зависят от температуры, но не зависят от концентрации реагентов). Если в реакции участвуют несколько молекул исходных веществ и образуется несколько молекул продукта (или продуктов), концентрации веществ в выражении для константы равновесия возводятся в степени, соответствующие их стехиометрическим коэффициентам. Так для реакции 3H2 + N2 =2NH3 выражение для константы равновесия записывается в виде:
K = [NH3]2 равн/[H2]3равн[N2]равн.
Для газообразных соединений вместо концентраций при записи константы равновесия можно использовать давление; очевидно, численное значение константы при этом может измениться, если число газообразных молекул в правой и левой частях уравнения не одинаковы.
Значение K может служить характеристикой необратимости реакции в данных условиях. Так, если K очень велика, это значит, что концентрации продуктов реакции намного превышают концентрации исходных веществ при равновесии, т.е. реакция прошла почти до конца. Например, для реакции NiO + H2 = Ni + H2O при 523 К (250° С) К = [Н2О]равн/[Н2]равн = 800 (концентрации твердых веществ постоянны и в выражение для К не входят). Следовательно, в замкнутом объеме после достижения равновесия концентрация паров воды будет в 800 раз больше, чем водорода (здесь концентрации можно заменить пропорциональными им давлениями). Итак, эта реакция при указанной температуре проходит почти до конца. А вот для реакции WO2 + 2H2 =W + 2H2O при той же температуре К = ([Н2]равн/[Н2О]равн)2 = 10–27, следовательно, диоксид вольфрама практически не восстанавливается водородом при 500 К. Условная запись [X] означает, что равновесная концентрация вещества X выражена в единицах моль/л. В общем случае константа равновесия Кс должна быть выражена через активности реагирующих веществ. Для идеальных растворов коэффициенты активности равны единице, и активности будут равны молярным концентрациям. Введение в систему, в которой протекает обратимая реакция, катализатора приведет к снижению энергии активации как прямой, так и обратной реакции на одну и ту же величину. Это означает, что катализатор в равной мере ускоряет обе реакции. Таким образом, для обратимых реакций роль катализатора заключается только в более быстром достижении равновесия. Катализатор не приводит к смещению химического равновесия .
Необходимым признаком химического (термодинамического) равновесия системы является неизменность её состояния во времени при заданных внешних условиях. Химическое равновесие носит динамический характер: какое количество исходных веществ вступает в реакцию, такое же образуется в результате обратной реакции. Достаточным доказательством существования химического равновесия является достижение его с обеих сторон, т.е. в результате протекания как прямого, так и обратного процессов. Химические равновесия чаще всего изучаются при постоянных давлении и температуре. Система стремится к минимуму свободной энергии, который наблюдается в состоянии равновесия. Константа равновесия считается величиной безразмерной.
Дата добавления: 2021-03-18; просмотров: 425;











