Химическое равновесие
Кинетическое химическое равновесие – состояние химической системы, при котором возможны реакции, идущие с равными скоростями в противоположных направлениях. При химическом равновесии концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Необратимые и обратимые реакции.Если слить растворы кислоты и щелочи, образуется соль и вода, например,
HCl + NaOH = NaCl + H2O, и если вещества были взяты в нужных пропорциях, раствор имеет нейтральную реакцию и в нем не остается даже следов соляной кислоты и гидроксида натрия. Если попытаться провести реакцию в растворе между образовавшимися веществами – хлоридом натрия и водой, то никаких изменений не обнаружится. В подобных случаях говорят, что реакция кислоты со щелочью необратима, т.е. обратная реакция не идет. Практически необратимы при комнатной температуре очень многие реакции, например,
H2 + Cl2 = 2HCl, 2H2 + O2 = 2H2O и др.
Необратимые реакции протекают до конца – до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью.
Многие реакции обратимы уже в обычных условиях, это означает, что в заметной степени протекает обратная реакция. Например, если попытаться нейтрализовать щелочью водный раствор очень слабой хлорноватистой кислоты, то окажется, что реакция нейтрализации до конца не идет и раствор имеет сильнощелочную среду. Это означает, что реакция HClO + NaOH 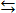 NaClO + H2O обратима, т.е. продукты этой реакции, реагируя друг с другом, частично переходят в исходные соединения. В результате раствор имеет щелочную реакцию. Обратима реакция образования сложных эфиров (обратная реакция называется омылением):
NaClO + H2O обратима, т.е. продукты этой реакции, реагируя друг с другом, частично переходят в исходные соединения. В результате раствор имеет щелочную реакцию. Обратима реакция образования сложных эфиров (обратная реакция называется омылением):
RCOOH + R'OH 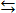 RCOOR' + H2O, многие другие процессы.
RCOOR' + H2O, многие другие процессы.
Как и многие другие понятия в химии, понятие обратимости во многом условно. Обычно необратимой считают реакцию, после завершения которой концентрации исходных веществ настолько малы, что их не удается обнаружить (конечно, это зависит от чувствительности методов анализа). При изменении внешних условий (прежде всего температуры и давления) необратимая реакция может стать обратимой и наоборот. Так, при атмосферном давлении и температурах ниже 1000° С реакцию
2Н2 + О2 = 2Н2О
еще можно считать необратимой, тогда как при температуре 2500° С и выше вода диссоциирует на водород и кислород примерно на 4%, а при температуре 3000° С – уже на 20%. В конце 19 в. немецкий физикохимик Макс Боденштейн (1871–1942) детально изучил процессы образования и термической диссоциации иодоводорода:
H2 + I2 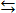 2HI
2HI
Изменяя температуру, он мог добиться преимущественного протекания только прямой или только обратной реакции, но в общем случае обе реакции шли одновременно в противоположных направлениях.
Дата добавления: 2021-03-18; просмотров: 396;











