Первое начало термодинамики
В термодинамике рассматриваются процессы, связанные с тепловыми явлениями. Термодинамика основывается на трех началах, или законах, вытекающих из обобщения всего многовекового опыта человечества. Начала термодинамики справедливы для любого тела или группы тел.
В термодинамике тело или группа тел, находящиеся во взаимодействии и мысленно обособленные от окружающей среды, называются системой.
В основу первого начала термодинамики положен закон сохранения энергии, впервые сформулированный Ломоносовым. Согласно этому закону взамен энергии одного вида, исчезающей в каком-либо процессе, появляется энергия другого вида, в количестве строго эквивалентном первому. Среди различных форм энергии, встречающихся в химических процессах, особенное значение имеет внутренняя энергия – U, которая находится в скрытом виде в каждом веществе и слагается из энергии поступательного, колебательного и вращательного движения элементарных частиц, а также из энергии их взаимодействия. Количество внутренней энергии системы зависит не только от природы составляющих ее веществ и их массы, но и от состояния системы, т.е. внешних условий. Из внешних условий, влияющих на внутреннюю энергию системы, следует учитывать объем – V, давление – P и температуру – T. Эти три переменных фактора определяют термодинамическое состояние системы и могут изменяться при любом физико-химическом процессе. Следовательно,
U = f(V, P, T)
Поскольку внутренняя энергия зависит от количества вещества, то ее относят к молю этого вещества. Единицей измерения внутренней энергии является тепловая единица – джоуль или калория. (1 кал = = 4,19 Дж).
Изменение внутренней энергии не зависит от пути перехода системы из одного состояния в другое и определяется только параметрами начального и конечного состояния этой системы.
Формами превращения внутренней энергии при изменении состояния системы являются теплота и механическая работа. Изменение внутренней энергии может происходить за счет подвода к системе энергии или отвода от нее тепла.
Изменение внутренней энергии может явиться результатом работы, совершаемой самой системой или над ней. Если система производит работу, преодолевая действие внешних сил, то запас внутренней энергии системы уменьшается и наоборот.
В общем виде первое начало термодинамики имеет следующую формулировку:
«В любом процессе приращение внутренней энергии – DU какой-нибудь системы равно количеству сообщенной системе теплоты – Q за вычетом совершенной системой работы – А».
Математически эта связь записывается как
DU = Q – A
Однако в термохимии считается положительным не приращение, а убыль внутренней энергии, не поглощение, а выделение тепла. Так как в дальнейшем мы будем пользоваться такой системой знаков, воспользуемся теми же буквенными обозначениями, но с черточками сверху. В этом случае знак перед ними должен быть изменен на обратный, то есть
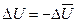 и
и  , тогда
, тогда
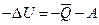 или
или 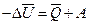 .
.
То есть убыль внутренней энергии системы равна сумме теплового эффекта и внешней работы реакции.
Различают тепловой эффект реакции, протекающей при постоянном объеме QV (изохорический процесс) и при постоянном давлении QP (изобарический процесс).
Если химическая реакция идет без изменения объема, то на преодоление сил внешнего давления работа не затрачивается и, следовательно,
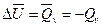
Такой процесс наблюдается при взаимодействии твердых и жидких веществ без образования газовой фазы.
Если химическая реакция протекает при постоянном давлении, часть энергии системы расходуется на совершение работы расширения. В этом случае наблюдается изменение объема на величину DV и совершается работа
A = P∆V
Тогда изменение внутренней энергии DU можно представить как
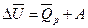 или
или 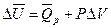
Рассмотрение таких процессов упрощается, если применить особую функцию, которая подобно внутренней энергии является функцией состояния. Эта функция получила название энтальпии или тепловой функции Гиббса.
Энтальпия выражается следующим образом:
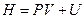
Следовательно, она отличается от внутренней энергии на величину работы расширения.
В частности, для изобарического процесса можно записать
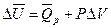 или
или 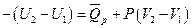 ;
;
 Преобразуя это выражение, получим
Преобразуя это выражение, получим
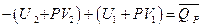 или учитывая выражение
или учитывая выражение 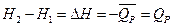
Иначе говоря, увеличение энтальпии системы в процессах, протекающих при постоянном давлении, равно поглощенной теплоте.
Таким образом, тепловой эффект реакции при постоянном давлении отличается от теплового эффекта реакции при постоянном объеме на величину совершенной работы
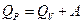
Наиболее часто наблюдаются изобарические процессы, к ним может быть отнесена и сварка плавлением.
Дата добавления: 2016-12-09; просмотров: 2011;











