Последовательность электродных процессов
При наличии нескольких видов ионов или недиссоциированных молекул электрохимически активных веществ возможно протекание нескольких электродных реакций. Рассмотрим последовательность их протекания на катоде и аноде.
Катодный процесс. Поскольку на катоде протекает реакция восстановления, поэтому прежде всего выделяются металлы, обладающие более положительным потенциалом.
Для катодного восстановления при электролизе водного раствора электролита все окислители можно разделить на три группы:
1. Ионы металлов, потенциал которых значительно отрицательнее, чем 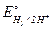 на катоде не восстанавливаются. К ним относятся ионы щелочных, щелочноземельных металлов и других, стоящих в ряду напряжений до алюминия включительно. При этом в кислых растворах (рН < 7) на катоде восстанавливаются катионы водорода:
на катоде не восстанавливаются. К ним относятся ионы щелочных, щелочноземельных металлов и других, стоящих в ряду напряжений до алюминия включительно. При этом в кислых растворах (рН < 7) на катоде восстанавливаются катионы водорода:
2Н++ 2ē = Н2 ,
а в нейтральных и щелочных (рН ≥ 7) - молекулы воды
2Н2O + 2 ē = Н2 +2OH-
2. Если EMe мало отличается от EH, то возможно совместное выделение металла и водорода. Так, происходит выделение свинца, олова, никеля, кобальта, хрома, кадмия, цинка и других металлов, находящихся в ряду напряжений между алюминием и водородом. Существенную роль в последовательности разряда ионов металлов играет перенапряжение водорода. Например, при электролизе водного раствора ZnSO4 при стандартных условиях на катоде должен протекать процесс восстановления катионов водорода ( 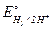 = 0 В), а затем цинка (
= 0 В), а затем цинка ( 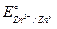 = -0,76 В). Но так как ηн велико и на цинке составляет 0,7 В, то потенциалы водорода и цинка обличаются и происходит их совместное выделение. При этом большая часть тока расходуется на выделение цинка.
= -0,76 В). Но так как ηн велико и на цинке составляет 0,7 В, то потенциалы водорода и цинка обличаются и происходит их совместное выделение. При этом большая часть тока расходуется на выделение цинка.
3. При любых плотностях тока EMe > EH. В этом случае будет происходить выделение только металла. На этом основано выделение меди, серебра, золота, платины и др. Например, при электролизе водного раствора хлорида меди на катоде идет только реакция:
Cu2+ + 2 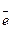 =Cu°.
=Cu°.
Анодный процесс. На аноде окисляются в первую очередь вещества, имеющие наиболее отрицательный потенциал. Различают электролиз с растворимыми и нерастворимыми (инертными) анодами. В первом случае возможен процесс Me-nē→Men+, если ЕMe имеет более отрицательное значение, чем потенциал других ионов или веществ. При электролизе с инертным анодом можно выделить следующие случаи:
а) растворение металлов
Me - nē→Men+
б) окисление ионов OH-
2OH-- 2ē→ 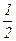 O2+ H2O
O2+ H2O
в) окисление других веществ, присутствующих в растворе или около электрода:
Redn- – nē = Ox0
Если потенциал металлического анода имеет отрицательнее потенциала ионов OH- или других веществ, присутствующих в растворе, в газовой фазе около электрода или не электроде, то происходит растворение металла. При этом протекает электролиз с растворимым анодом. Так, например, происходит электролиз сульфата меди с медным анодом:
Катод: Cu2+ + 2ē→Cu°
Анод: Cu - 2ē→Cu2+
Если потенциал металлического анода близок к потен-
циалу других электродных процессов, то наряду с растворением металла на аноде протекают также другие процессы, например, разряд ионов OH-.
Если потенциал металла или другого проводника первого рода, используемого в качестве анода, имеет более положительное значение, то протекает электролиз с нерастворимым анодом. В качестве анода применяются графит, золото, платина, диоксид свинца и другие. Некоторые металлы практически не растворяются из-за высокой анодной поляризации, например, никель, железо в щелочном растворе, свинец в H2SO4, титан, тантал, нержавеющая сталь. Явление торможения анодного растворения металла пассивацией.
Потенциал кислородного электрода в широкой области рН отрицательнее потенциалов галоидных ионов (за исключением иона I-). Однако при наличии в растворе ионов галогенов вследствие высокой поляризации выделения кислорода в первую очередь на аноде выделяется йод, затем бром. При наличии Cl- - ионов в растворе и малых значениях анодной плотно-
сти тока ia идёт выделение кислорода, а при высоких ia параллельно начинает выделяться хлор. Фтор из-за положительногозначения потенциала не может быть выделен из водных растворов, его получают электролизом расплавленных фторидов. На аноде не окисляется также ионы SO42-, PO43-, NO3-, т.е. содержащие кислород.
Законы Фарадея.Электролиз подчиняется законам Фарадея.
1. Массы веществ (g), выделившихся на электродах при электролизе, прямо пропорциональны количеству электричества, прошедшего через электролит, т.е.:
g = kQ
где k – коэффициент пропорциональности численно равный электрохимическому эквиваленту 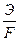 , Q – количество электричества; Q = I ּ τ (I – сила тока, τ – длительность электролиза)
, Q – количество электричества; Q = I ּ τ (I – сила тока, τ – длительность электролиза)
2. Равные количества электричества образуют при электролизе различных соединений эквивалентные количества вещества. При пропускании одного фарадея электричества (F) выделяется 1 г - эквивалент вещества, например, элемента
Э = А/n,
где А – атомная масса элемента; n – валентность элемента
Об эффективности процессов на электродах судят по выходу вещества по току (А):
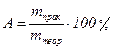
где mпрак – масса выделившегося при электролизе вещества; mтеор – масса вещества теоретически рассчитанная по закону Фарадея при заданных I и τ.
Дата добавления: 2016-12-09; просмотров: 7240;











