Теоретические основы электролиза
Электролизом называют совокупность окислительно-восстановительных процессов, которые происходят под действием электрического тока, подаваемого от внешнего источника, на электродах, погруженных в расплав или раствор электролита. При электролизе происходит превращение электрической энергии в химическую. Под действием поля движение ионов в электролите становится направленным. Отрицательные частицы (анионы) перемещаются к аноду (А), который
подключен к положительному полюсу источника тока. На аноде протекает реакция окисления. Положительно заряженные ионы направляются к катоду (К), подключенному к отрицательному полюсу источника тока. На катоде протекает реакция восстановления. Для осуществления электролиза используют источник электрического тока, электролизер, в который помещают расплав или раствор электролита и электроды. В большинстве случаев применяются металлические электроды, но иногда могут быть использованы и неметаллические, проводящие электрический ток (например, графитовые).
В качестве примера рассмотрим электролиз расплава хлорида натрия. При прохождении тока через расплав катионы натрия Na+ под действием сил электрического поля движутся к катоду, минусу (-). Здесь, взаимодействуя с приходящими по внешней цепи электронами, они восстанавливаются:
Na+ + ē ═ Na
Анионы хлора, перемещаясь к аноду и теряя электроны окисляются:
2Сl- - 2ē ═ Cl2
Таким образом, в процессе электролиза протекает окислительно-восстановительная реакция, но не самопроизвольно, как в гальваническом элементе, а за счет энергии электрического тока, подводимого извне.
Рассмотрим условия, необходимые для протекания электролиза. В результате работы внешнего источника тока на катоде возникает избыток электронов. Поэтому катод выступает в роли восстановителя по отношению к разряжающимся на нем частицам. Напротив, анод проявляет функции окислителя.
Таким образом, для того чтобы на катоде стал возможным разряд какого-либо вещества необходимо повышать на
пряжение на электролизере до тех пор, пока потенциал катода не станет меньше окислительно-восстановительного потенциала разряжающегося вещества:
Ek < E(Ox/Red)к , (1)
где Ek - потенциал катода; E(Ox/Red)к потенциал разряжающегося вещества.
В анодном процессе соотношение потенциалов электрода и разряжающегося вещества обратное:
Ea > E(Ox/Red)а (2)
где Ea - потенциал анода; E(Ox/Red)а - потенциал разряжающегося вещества, Ox - окисленная форма вещества; Red - восстановленная форма вещества.
Скорость электродных процессов. Обеспечение только необходимых условий (1) и (2) не всегда является достаточным для того, чтобы электродный процесс проходил с требуемой скоростью. Экспериментально установлено, что скорость электродной реакции зависит от природы разряжающихся частиц, их концентрации и скорости их диффузии; от материала электрода, состояния его поверхности и что особенно важно, от величины потенциала электрода. Зависимость скорости катодного и анодного процессов i от потенциала E представлена на рис. 64.
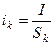 (3)
(3)
где I – сила тока в электрической цепи; Sк – площадь поверхности катода.
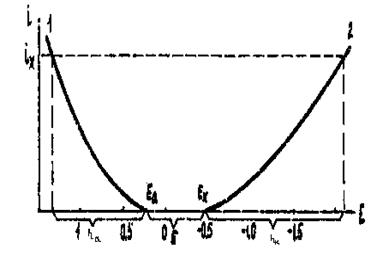
Рис.64. Поляризация электродов при электролизе
I - поляризация анода, 2 - поляризация катода
Скорость, например, анодного процесса определяется значением плотности тока iА
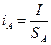
На этом рисунке точками А и К обозначены равновесные потенциалы веществ, разряжающихся на катоде и аноде. Стрелками указано направление изменения катодного и анодного потенциалов при увеличении напряжения на электролизере.
Из рис. 8 видно, что скорость восстановления катионов увеличивается по мере смещения потенциала катода в область отрицательных значений. Скорость же анодного процесса возрастает при смещении потенциала анода в область положительных значений.
Процесс разряда каких-либо веществ на катоде или аноде становится принципиально возможным лишь после того, как
потенциалы электродов приобретут значения К или А соответственно. Однако для того, чтобы реакция разряда происходила с заданной скоростью iх, потенциал катода должен быть смещен на величину ηк, а потенциал анода на величину ηа от равновесных значений. Указанные смещения потенциалов требуют дополнительного увеличения напряжения на электролизере. Поэтому их обычно называют катодным (ηк) и анодным (ηа) перенапряжением. Следует отметить, что явление изменения потенциалов электродов, т.е. возникновения поляризации обусловлено целым рядом причин. Причиной поляризации электродов является замедленность какой-либо стадии электродного процесса. Любой электродный процесс представляет собой сложную гетерогенную реакции, состоящую из ряда последовательных стадий. Например, при восстановлении ионов металла на катоде возможны следующие стадии: доставка ионов металла к поверхности электрода, дегидратация ионов в двойном электрическом слое, адсорбция ионов на поверхности электрода, разряд ионов, стадия внедрения атомов металла в кристаллическую решетку. Каждая из этих стадий может быть замедленной. Если на электроде протекает только одна реакция, то вместе термина "поляризация" применяют термин "перенапряжение" (η).
Электрохимическое перенапряжение при выделении металла на катоде, как правило, невелико. Так, для меди приблизительно равно десяткам милливольт, а такие металлы, как ртуть, серебро, олово и свинец выделяют из водных растворах их солей выделяются почти без перенапряжения. Наибольшие значения η достигает при выделении металлов группы железа.
Если замедлена химическая реакция в растворе электролита, то говорят о химическом перенапряжении. Может быть замедлена стадия построения или разрушения кристаллической решетки, тогда имеется фазовое перенапряжение.
В общем случае реальный потенциал Еi электрода, через который пропускается ток определяется выражением:
E(i) = Eравн(Ме)+∆ φ (4)
где Eравн(Ме) - равновесный потенциал электрода, ∆ φ -сверхпотенциал, включает в себя различного вида поляризации электрода.
Для того чтобы мог происходить электролиз и через электролизер проходил ток надо приложить определенное напряжение U, которое слагается из разности равновесных потенциалов ∆ E (ЭДС) перенапряжения катода и анода, а также омического падения напряжения в проводниках IR:
U = ∆ E+ ηа+ ηk+IR (5)
Из уравнения (5) видно, что напряжение может быть снижено уменьшением поляризации электродов и омического сопротивления.
Поляризация (концентрационная и электрохимическая) может быть снижена увеличением поверхности электродов, температуры, концентрации реагентов, перемешиванием, уменьшением силы тока.
Рассмотрим схему электролиза раствора хлороводорода с платиновыми нерастворимыми анодами и определим ∆ E:
НСl = Н+ + Cl-
катод: 2 Н+ + 2  = H2;
= H2; 
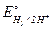 = 0,0 В
= 0,0 В
анод: 2 Сl- - 2 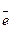 = Cl2;
= Cl2; 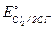 = 1,36 В
= 1,36 В
где 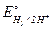 и
и 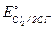 - стандартные окислительно-восстановительные потенциалы с концентрацией ионов в растворе 1 г - ион/л.
- стандартные окислительно-восстановительные потенциалы с концентрацией ионов в растворе 1 г - ион/л.
Один из электродов в электролизере является водородным, а другой - хлорным. Таким образом, разность потенциалов двух указанных электродов будет равна:
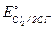 -
- 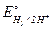 = 1,36 – 0,0 = 1,36 В.
= 1,36 – 0,0 = 1,36 В.
Очевидно, эту ЭДС и надо преодолеть против направленной в противоположную сторону эдс от внешнего источника электричества.
Перенапряжение водорода.При рассмотрении электролиза растворов нельзя упускать из вида, что, кроме электролита, в растворе имеется еще ионы Н+ и ОН-, являющиеся продуктом диссоциации воды. Поэтому для электролиза водных растворов большой интерес представляет скорость процесса:
2Н++ 2 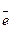 = Н2 (
= Н2 ( 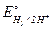 = 0,0 В).
= 0,0 В).
Выделение водорода на катоде происходит при потенциале более отрицательном, чем равновесный потенциал, зависящий от рН раствора электролита:
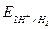 =
= 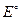 +
+ 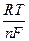 ln
ln 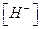 - η
- η 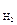 ;
;
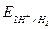 =
= 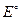 +0,059 lg
+0,059 lg 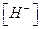 - η
- η 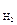 , т.к. рН = - lg [H+], то
, т.к. рН = - lg [H+], то
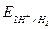 = -0,059 pH - η
= -0,059 pH - η 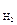
где 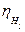 - это дополнительное напряжение, требующееся для разряда катионов водорода.
- это дополнительное напряжение, требующееся для разряда катионов водорода.
Процесс восстановления Н+ - многостадийный процесс и в общем виде может быть представлен следующими стадиями:
1) процесс дегидратации ионов гидроксония (Н3O)+;
2) адсорбция Н+ на поверхности катода;
3) электрохимическая стадия Н+ + 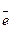 = Н;
= Н;
4) стадия образования молекулы водорода 2Н+→H2;
5) образование пузырьков газа nH2→H2(n);
6) отрыв пузырьков газа от катода.
Причина водородного перенапряжения заключается в возможном торможении той или иной стадии этого процесса. Величина 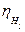 зависит от плотности тока, природы металла, состояния поверхности катода. Эта зависимость выражается уравнением Тафеля:
зависит от плотности тока, природы металла, состояния поверхности катода. Эта зависимость выражается уравнением Тафеля:
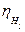 = a+b lg i
= a+b lg i
где a и b - константы
Константа “а” зависит от природы металла и состояния его поверхности. Так, например, при i = 1 А/дм2 величина “а” имеет следующие значения для различных металлов:
Pt - 0,1 В, Zn - 1,24 В
Fe - 0,7 В, Pb - 1,56 В
Константа “в “ зависит от температуры раствора и при 20 °С для всех металлов составляет величину около 0,12 В.
Таким образом, водородное перенапряжение зависит от плотности тока, природы металла, кислотности электролита (рН), температуры, состояния поверхности электрода.
Дата добавления: 2016-12-09; просмотров: 4081;











