Техническое применение электролиза
Электролиз нашёл широкое и разнообразное применение в технике. Одной из важнейших областей является гидроэлектрометаллургия, которая подразделяется на две категории: электролитическое рафинирование и электроэкстракцию.
Электролитическое рафинирование – это процесс очистки металлов и одновременного извлечения ценных компонентов из металлов, полученных металлургическим путем. При электролитическом рафинировании металл, который необходимо очистить от примесных элементов, используют в качестве анодов. При прохождении тока через раствор металл подвергается анодному растворению, а ионы металла восстанавливаются на катоде и образуют осадок чистого металла. Содержащиеся в аноде примеси либо переходят в электролит (откуда периодически удаляются), либо остаются нерастворенными и выпадают в виде анодного шлама.
В качестве примера можно рассмотреть электрорафинирование меди. Основным компонентом раствора служит CuSO4 – распространенная и дешёвая соль. Для увеличения электропроводимости раствора в него добавляют H2SO4. Кроме того, в раствор вводят небольшие количества добавок для получения плотного компактного осадка. Анодами служит черновая медь, полученная в результате металлургических процессов. Катода – тонкие листы электролитной меди.
При прохождении тока (ia = 300 А/дм2) медь и примеси с более отрицательным электродным потенциалом (Fe, Co, Zn) анодно растворяется. Примеси накапливаются в электролите в виде сульфатов. Примеси благородных металлов (Au, Ag) выпадают в осадок, образуя анодный шлам, который затем извлекается и перерабатывается.
Схема электролиза:
Анод: Cu - 2ē = Cu2+ (Fe – ē = Fe2+ , Zn - 2ē= Zn2+)
Катод: Сu2+ + 2ē= Cu0
Процесс ведется при перемешивании, чтобы восстановление не сопровождалось большим перенапряжением, а следовательно большим расходом электроэнергии.
В настоящее время ведутся работы по усовершенствованию процесса электрорафинирования, который заключается в наращивании катодного осадка на бесконечной ленте, продвигающейся через электролизёр с электролитом. Метод электролитического рафинирования широко применяется для получения чистых металлов Ni, Pb, Sn, Zn, Mn, Ag, Au.
Электроэкстракция. Это извлечение металлов из их смеси методом электролиза. В этом случае руду подвергают выщелачиванию, т.е. растворяют в определенном растворителе. Раствор, содержащий извлекаемый металл, после очистки от примесей направляют на электролиз с нерастворимыми анодами, часто свинцовыми. Электролиз ведется при интенсивном перемешивании, чтобы обеспечить доставку разряжающихся ионов к катоду. Отличие от электрорафинирования заключается в том, что электролит содержит меньшую концентрацию ионов, а это приводит к большей катодной поляризации.
Например, при электроэкстракции меди из разбавленных сернокислых электролитов протекают следующие процессы:
На катоде: Cu2+ + 2ē = Cu
На аноде: Pb - 2ē + SO42 - = PbSO4
PbSO4 + 2H2O - 2ē = PbO2 + 4H+ + SO42-
Образующийся осадок сульфата свинца осаждается на поверхности свинцового анода, его потенциал становиться положительнее и создаются условия для выделения кислорода.
Метод электроэкстракции широко применяется при извлечении из обедненных растворов никеля, кобальта, марганца, хрома, меди, серебра, золота и других металлов.
Достоинством гидроэлектрометаллургических методов является возможность переработки бедных руд и извлечения побочных продуктов, высокая чистота получаемого основного металла.
Другой важнейшей областью применения электролиза является гальванотехника, которая включает два различных направления: гальваностегию и гальванопластику.
Гальваностегия – это процесс нанесения металлических покрытий на поверхность изделий электролизом. Хорошо
очищенную и обезжиренную деталь погружают в ратвор электролита, содержащий ионы того металла, которым ее необходимо покрыть и присоединяют в качестве катода к цепи постоянного тока. Электролиз ведут как с растворимыми, так и нерастворимыми анодами.
Из многочисленных применяемых в технике гальванотехнических процессов важнейшими являются хромирование, цинкование, никелирование, кадмирование, лужение, меднение, серебрение, золочение и др.
Гальванопокрытия разделяются на защитные, зашитно-декоративные и специальные. Защитные покрытия, например цинковые, кадмиевые, оловянные наносятся для защиты изделий от коррозии. Защитно-декоративные покрытия предназначены не только для защиты от коррозии, но и для улучшения внешнего вида (никелевые, хромовые, медные, серебряные, золотые). Специальные покрытия используютдля улучшения различных физико-механических и физико-химических свойств (оловянные, медные, серебряные, золотые и др.). В последние десятилетия все более широкое применение в качестве специальных покрытий находят гальванические сплавы.
Рассмотрим примеры получения некоторых гальванопокрытий.
Хромирование. Хромирование получило широкое применение в промышленности при изготовлении таких изделий, как измерительный и режущий инструменты, валы, оси, цилиндры двигателей, лопатки водяных и паровых турбин и т.д. Широко применяется электролитическое хромирование для защиты от коррозии и с целью декоративной отделки поверхности изделий.
Электролитические осадки хрома можно получать из растворов как трех -, так и шестивалентных соединений хрома. В настоящее время применяют пока шестивалентные соединения хрома - раствор хромовых кислот, которых металл находится в основном в виде комплексных анионов СrО4 2-, HCrO4-, Сr2O72-.
Электроосаждение хрома из раствора хромовой кислоты является одним из наиболее сложных процессов в гальваностегии. Он имеет ряд отличительных особенностей по сравнению с выделением многих других металлов: высокий отрицательный потенциал восстановления хромат - ионов, низкий выход по току хрома (15 - 30 % в зависимости от катодной плотности тока ik и длительности электролиза τ), высокие плотности тока, обязательное присутствие в растворе некоторых посторонних анионов, необходимость применения нерастворимых анодов, очень низкая рассеивающая способность электролита.
Чрезвычайная сложность явлений, сопровождающих процесс хромирования, не позволяет пока признать вопрос о механизме решенным однозначно. Однако предположение о непосредственном восстановлении Сr6+ до Сr° представляется экспериментально более обоснованным. Восстановление хрома можно представить уравнением:
CrO42- + 8H+ + 6ē = 2Cr0 + 4H2O
Особенностью процесса является то, что посторонние анионы адсорбируясь на поверхности катода, препятствуют образованию на ней прочной окисной пленки и тем самым облегчают сорбцию и восстановление хромат-ионов.
Основными компонентами хромового электролита являются хромовые кислоты H2CrO4 и H2Cr2O7, посторонние анионы (SO42- и SiF62-) и соединения трехвалентного хрома. На практике чаще всего применяют электролит, содержащий 200 - 300 г/л CrO3 и 2,5 г/л Н2SO4.
Основным недостатком электролита является его повышенная токсичность. Применение электролитов хромирования c относительно низкой концентрацией CrO3 позволяет уменьшить загрязнение окружающей среды и улучшить условия труда в гальванических цехах. Известны способы нанесения хромовых покрытий из двух электролитов с концентрацией
CrQ3 60 г/л и 150 г/л. Осаждение хрома из этих электролитов можно проводить как в стационарных (с использованием постоянного тока), так и в нестационарных (с использованием импульсного тока) режимах. Покрытия осаждаются зеркально-блестящие, высокой коррозийной стойкости.
Цинкование. Электролитические покрытия цинком применяются для защиты от коррозии изделии из черных металлов (сталь, чугун) от коррозии. Цинком покрывают стальные листы, проволоку, ленту, детали машин и крепежа, водопроводные трубы, питательные резервуары и предметы домашнего обихода (из черного металла), соприкасающиеся с пресной водой при температуре 60 - 70 °С; бензобаки, бензино- и маслопроводы и др.
Электролиты для цинкования можно разделить на две основные группы: простые кислые (сернокислые, хлористые, борфтористоводородные и др.), в которых цинк находится в виде гидратированных ионов, и сложные комплексные, в которых оба металла присутствуют в виде комплексных ионов, заряженных отрицательно (анионы) или положительно (катионы). К комплексным электролитам относятся щелочно-цианистые, пирофосфатные, аммиакатные, аминокомплексные с различными органическими лигандами и др. Для цинкования применяются также щелочные нецианистые или цинкатные электролиты.
Наиболее широко применяют кислые электролиты. Кислые электролиты применяют главным образом для цинкования
изделий простой формы. В присутствии некоторых органических добавок, повышающих катодную поляризацию, из кислых электролитов можно получать относительно равномерные по толщине светлые осадки и на рельефных деталях.
Одним из существенных недостатков сернокислых электролитов цинкования является их низкая буферная емкость. Для повышения буферной емкости электролитов вводят, например, сульфат алюминия, который тормозит образование
основных соединений цинка (ZnO , Zп(OН)2 и др.), ухудшающих качество покрытий. Однако в присутствии Al2(SO4)3 нельзя повышать плотность тока более 2 А/дм2 т.к. при более высоких ее значениях повышается рН прикатодного слоя (рНs) до 4,2 и более, что является причиной резкого ухудшения качества покрытий.
В последние годы разработаны новые электролиты цинкования, в которые вводят более эффективные буферные добавки, чем сульфат алюминия - молочную, янтарную и другие кислоты. Разработанные электролиты, в сравнении о известными, позволяют повысить скорость процесса в 1,5 - 2 раза, а покрытия осаждаются лучшего качества, полублестящие и более коррозионностойкие (в 1,5 - 2 раза). В этих электролитах можно вести электролиз при плотности тока 5 А/дм2, температуре 18 - 25 °С и рН - 2,3 - 3,5.
Электроосаждение сплавов. В последние десятилетия большое внимание уделяется изучению процессов электроосаждения сплавов как у нас в стране, так и за рубежом. Этот интерес вызван тем, что электролитические сплавы, используемые в качестве покрытий, характеризуются в большинстве своем ценными физико-химическими и физико-механическими свойствами, отличными от свойств покрытий из чистых металлов. Применяют сплавы из двух и более компонентов. Так, например, сплав меди с цинком (желтая латунь) широко применяется для улучшения адгезии металла с резиной, сплав меди с оловом (белая бронза) обладает высокой отражательной спо-
собностью. Для защиты изделий от коррозии значительный интерес представляют сплавы хрома с металлами группы же-
леза, а также хром-вольфрам, хром-молибден, хром-рений. Очень устойчивыми в агрессивных средах являются сплавь циркония и ванадия (Zr - Zn., Zr - Cd, V - Ni - Сr). Следует отметить, что уже изучено свыше 300 сплавов. Однако не все они нашли применение в промышленности. Технология электролитического получения многих сплавов разработана сравнитель-
но недавно и еще полностью не установлены их свойства.
Особенностью процессов электроосаждения сплавов является то, что совместный разряд ионов различных металлов характеризуется одним из двух типов электрохимических систем.
В системах первого типа закономерности процесса при совместном разряде остаются такими же, как и при раздельном разряде ионов, такие систем называются несопряженными.
В системах второго типа (сопряженных, системах) вследствие взаимного влияния разряжающихся ионов скорости протекания отдельных электродных процессов при совместном разряде изменяются.
В практике электроосаждения сплавов чаще всего встречаются системы второго типа, которые называются реальными сопряженными в отличие от систем первого типа.
Для совместного разряда ионов при данных условиях необходимо соблюдение равенства:
E10 + RT/z1F·ln a1 – η1 = E20 + RT/z2F·ln a2 – η2 ,
где Е10 и E20 - стандартные потенциалы металлов,
a1 и a2 - активности разряжающихся ионов,
η1 и η2 - перенапряжение разряда ионов.
Согласно этому уравнению электроосаждение двух металлов легко осуществимо, если стандартные потенциалы и активности ионов, очень близки, близкие значения имеют так
же перенапряжение или катодная поляризация. В этом случае совместный разряд ионов возможен даже из растворов простых солей, как например, при получении никель-кобальтовых сплавов из сернокислых электролитов.
Графически эти закономерности для идеальных несопряженных систем представлены на рис. 65, где EМе1 и ЕМе2 потенциалы выделения первого и второго металлов, зависящие от стандартные потенциалов соответствующих металлов и актив-
ности их ионов в электролите.
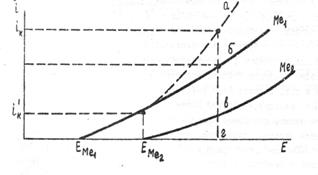
Рис.65. Поляризационные кривые при совместном
электроосаждении металлов Ме1 и Ме2:
EMe1 - Me1, EMe2 - Me2 - парциальные поляризационные кривые, характеризующие скорость разряда соответствующих ионов в зависимости от катодного потенциала. Отрезок бг - скорость разряда ионов металла Me1, вг - второго металла Мe2, аг - скорость осаждения сплава.
Если стандартные потенциалы металлов значительно отличаются друг от друга, то сблизить потенциалы их выделения можно соответствующим изменением перенапряжения и активности ионов. При увеличении или уменьшении активности одновалентных ионов в электролите в 10 раз равновесный потенциал сдвигается в отрицательную или положительную сторону всего лишь на 0.059 В, т.е. влияние изменения активности ионов в электролите значительно меньше разности стандартных потенциалов, обусловленных природой металла. Сближение потенциалов катионов металлов, различающихся величинами E°, переводом их в прочные комплексные соединения, позволяет осуществлять совместное их электроосаждение.
Для получения гальванических покрытий сплавами наиболее широкое применение получили электролиты с различными комплексными анионами: цианистые, станнатные, цинкатные, пирофоофатные и др. Используя для сближения потенциалов связывание катионов металлов в комплексные соединения, удалось получить, например, сплавы Cu – Zn, Zn – Cd, Fe – Ni – Co, Sn – Ni и др.
В последние годы получены сплавы хрома с металлами группы железа (Сr – Со, Сг - Ni , Cr – Fe, Fe – Ni - Cr) из электролитов, содержащих трехвалентные соединения хрома и различные комплексообразующие и блескообразующие добавки. Сплавы эти обладают ценными физико-механическими и физико - химическими свойствами: жаростойкостью, износостойкостью, коррозионное стойкостью и т.д. Значительный интерес представляет, например, сплав Ni – Cr - благодаря высокой жаро - и коррозионной стойкости. Совместное электроосаждение хрома и никеля затруднено существенным различием катодной плотности тока, необходимой для их выделения (20 - 100 А/дм2 для хрома и не более 5 А/дм2 для никеля). Для совместного электроосаждения никеля и хрома в сернокислый электролит вводят различные органические добавки, например, янтарную кислоту, моноэтаноламин и 1,4 – бутиндиол. В присутствии этих добавок осаждаются зеркально-блестящие коррозионно-стойкие электролитические покрытия.
Гальванопластика – это процесс получения металлических копий. Он состоит из нескольких этапов: 1) изготовление металлических или неметаллических форм, представляющих копию с оригинала; 2) нанесение токопроводящего слоя на неметаллические формы (механическое втирание графита в по-
верхность формы); 3) нанесение разделительного слоя, чтобы
легче было отделить копию от металлической формы (слой окислов или солей, которые наносят химическим способом).
Форму, изготовленную специальным образом, помещают в электролитическую ванну и подключают к катоду. Аноды могут быть растворимые или нерастворимые. Электролиты в гальванопластике используют те же, что и в гальваностегии. Осаждение металла осуществляется на проводящий и разделительный слой. Металл осаждается либо на металлические фор-
мы, покрытые разделительным слоем, либо на неметаллические формы, покрытые проводящим слоем. Обычно первичное покрытие ведут без перемешивания при малых плотностях тока. После затягивания формы металлом в первой ванне, ее переносят во вторую.
Широкое применение электролиз нашел в металлургической промышленности для получения многих металлов. Так, например, электролизом расплавленных соединений получают щелочные и щелочноземельные металлы (алюминий, магний, натрий и др.). Электролизом также получают многие газообразные вещества – водород, кислород, хлор и др., органические соединения, металлические порошки.
За последние годы большое промышленное значение получили электрохимические методы обработки поверхности: электролитическое травление, электрополирование, анодирование, анодно-механическая обработка.
Электролитическое травление – это процесс удаление окислов с поверхности металлов при помощи электрического тока. При травлении происходит также выявление структуры основного металла. Электролитическое травление можно вести как на аноде, так и на катоде. Чаще других используется серная кислота. При катодном травлении на поверхности изделия выделяется водород: 2H+ + 2ē = H2. Пузырьки водорода разрыхляют пленку окислов и удаляют ее. При катодном травлении возникает опасность наводороживания металла, поэтому
катодное травление тонкостеных деталей не допускается.
При анодном травлении выделяется кислород, пузырьки которого механически удаляют окислы с поверхности металла.
Электрохимическое полированиетакже как и механическое полирование предназначено для сглаживания рельефа поверхности и улучшения внешнего вида изделия. Полирование осуществляется на аноде, а в качестве катодов используют металлы, химически стойкие в данном электролите. Например, для полирования меди применяют медные катоды, которые по-
гружают в электролит, содержащий хромовый ангидрид и фосфорную кислоту. Вследствие разной толщины пленки происходит растворение металла на выступах. Поскольку электролит имеет большую вязкость, продукты анодного растворения накапливаются у поверхности, образуя прочную пленку. Электрод поляризуется, начинается окисление воды, выделяется кислород и одновременно происходит сглаживание поверхности.
Анодное оксидирование (анодирование) широко применяется для обработки металлов и, прежде всего алюминия. Алюминиевое изделие играет роль анода электролизера. Электролитом служит раствор серной, ортофосфорной, хромовой, борной или щавелевой кислот, катодом может быть металл, не взаимодействующий с раствором электролита, например нержавеющая сталь или свинец. На катоде выделяется водород, на аноде происходит образование оксида алюминия А12O3. Суммарный процесс на аноде можно представить следующим уравнением:
2Аl + ЗН2O - 6 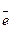 = Аl2O3 + 6Н+
= Аl2O3 + 6Н+
Механизм реакции имеет сложный характер. Электродная реакция протекает в несколько стадий. Наряду с образованием оксида происходит его частичное растворение в кислоте:
Аl2O3 + 6Н+= 2Аl3+ + ЗН2O
В результате пленка становится пористой, через поры пленки проникают ионы и процесс роста пленки продолжается. Полученная пленка Аl2O3 имеет ценные свойства. Она весьма пориста, причем размеры пор очень малы. Вследствие этого пленка может быть пропитана различными составами, повышающими коррозионную стойкость поверхности. Красители также могут придать поверхности разнообразную окраску, что используется при декоративной обработке алюминия и его сплавов.
Оксидная пленка на алюминии имеет высокую твердость, поэтому после анодирования и пропитки оксидного слоя смазкой значительно повышается износостойкость деталей. В растворах борной, щавелевой и лимонной кислот получаются тонкие плотные пленки с высоким электросопротивлением. Например, на алюминии формируются оксиды высокой чистоты с большим электросопротивлением (1014 Ом/см), поэтому окcидирование используется для получения изолирующих слоев на пленках, применяемых в электрических конденсаторах и других устройствах.
В последние годы пленки пористого анодного оксида алюминия нашли применение для создания наноструктур с высокой степенью упорядоченности. Пористый оксид алюминия (ПОА) используют в качестве селективных мембран, двухмерных фотонных кристаллов, матриц для получения нанотрубок.
Кроме алюминия производят также электрохимическое оксидирование магния, меди и титана, например, по реакции
Mg + 2Н2O → Mg (ОН)2 + 2Н+ + 2е
Электролиз нашел применение в различных отраслях в технике, причем области его использования непрерывно расширяются. Например, в последние годы разработаны электро-
химические преобразователи информации и электрохромные устройства, в основе действия которых лежат законы электролиза.
Важнейшим техническим применением электролиза является электрохимическая анодная обработка металлов и сплавов. Для изменения размеров и формы, а также состояния
поверхности металлических изделий используют электрохимические способы обработки, при которых производится электрохимическое фрезерование, шлифование, резка, сверление и др.
Анодная обработка изделий для придания им требуемой формы получила название электрохимической обработки металлов (ЭХОМ). Этот способ обработки металлов во многих случаях имеет важные достоинства, так как позволяет обрабатывать детали сложной конфигурации и металлы, которые механически или вообще не могут быть обработаны, или обрабатываются с большим трудом (например, очень твердые металлы и сплавы). Кроме того, струмент (катод) при этом не изнашивается, а обработка не влечет изменения структуры металла. К недостаткам ЭХОМ относится большой расход энергии, поэтому этот метод не применяется для обработки обычных металлов, сплавов и изделий простой конфигурации. Как и при обычном электролизе с растворимыми анодами, при ЭХОМ происходит анодное растворение металла: Мe - пе —> Мen+. На катоде, который при электрохимической обработке называют инструментом, обычно выделяется газообразный водород:
2Н+ + 2ē = Н2.
Особенностью ЭХОМ по сравнению с другими методами электролиза является высокая скорость растворения металлов. Плотность тока при электрохимической обработке металлов в сотни и тысячи раз выше плотности тока других электрохимических процессов. Для обеспечения высоких скоростей
процесса (высоких плотностей тока) при относительно невысоких напряжениях необходимо снизить омическое падение напряжение и поляризацию электродов. Для этого уменьшает-
ся зазор между электродами (до 0,1 мм) и используется раствор электролита с высокой электрической проводимостью. Для снижения поляризации и предотвращения пассивации анода необходимо принудительно с высокой скоростью выводить продукты анодного растворения металла из зазора между анодом и катодом. Электрохимически обрабатываемое изделие служит анодом и растворяется при прохождении тока (рис.66).
К отрицательному полюсу источника тока подключается катод (инструмент), обычно изготавливаемый из стали. На катоде выделяется водород. Между электродами сохраняется небольшой зазор, по мере растворения анода передвигают катод, чтобы сохранить малое расстояние между анодом и катодом. В зазор между электродами подается под давлением раствор электролита, в данной установке через полость в центре катода. Раствор электролита выносит из межэлектродного пространства продукты анодного растворения и газообразные продукты катодной реакции. Последние затем удаляются в атмосферу, а продукты растворения тем или иным способом выводятся из раствора электролита. В качестве растворов электролитов для обработки сталей и многих цветных металлов (никель, медь, кобальт, титан) и их сплавов применяется раствор NaCl; для обработки алюминия, цинка, олова и их сплавов — раствор NaNО3, для обработки молибдена и вольфрама - раствор NaOH.
В настоящее время ЭХОМ используется для обработки лопаток турбин, штампов и пресс-форм, твердых и тугоплавких металлов и сплавов, получения и обработки отверстий и полостей для фрезерования, точения и шлифования различных изделий, заточки инструмента.
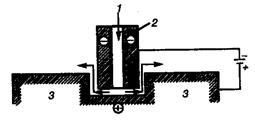
Рис. 66. Схема электрохимической обработки металлов:
1 - раствор электролита; 2 - катод (инструмент);
3 - анод (изделие)
Следует отметить, что области применения электролиза непрерывно расширяются. Например, в последние годы разра-
ботаны электрохимические преобразователи информации и электрохромные устройства, основу действия которых составляют законы электролиза.
Дата добавления: 2016-12-09; просмотров: 4898;











