Гальванических элементах
ЭДС работающего элемента с течением времени уменьшается. Причиной этого является поляризация электродов. Поляризация - смещение величины электродного потенциала от его равновесного значения при прохождении тока.
Δ E = Еi - Ep
где Δ Е - поляризация; Еi - потенциал электрода при прохождении тока; Ep -равновесный потенциал. В элементе Даниэля - Якоби с растворением цинкового электрода накапливаются ионы Zn2+ в приэлектродном слое. В уравнении Нернста связь потенциала с концентрацией имеет вид:
E 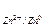 = E
= E 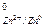 +
+ 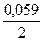 lg [Zn2+]; при [Zn2+] = 1 г – ион / л
lg [Zn2+]; при [Zn2+] = 1 г – ион / л
Е = Е0 = -0,76 В.
Если концентрация увеличилась в 100 раз, то:
E 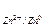 = -0,76 +
= -0,76 + 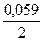 lg 102 = - 0,702 В
lg 102 = - 0,702 В
Это приводит к повышению потенциала цинка. Таким образом, при анодной поляризации потенциал смещается в положительную сторону.
У медного электрода концентрация катионов меди Cu2+ уменьшается в результате их восстановления и потенциал меди понижается:
E 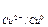 = 0,34 +
= 0,34 + 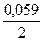 lg 10 -2 = 0,282 В
lg 10 -2 = 0,282 В
При катодной поляризации потенциал катода смещается в отрицательную сторону.
В результате уменьшается ЭДС элемента
ЭДС = 0,282 В - 0,702 В = 0,984 В (< 1,1 В)
Изменение величины потенциала электрода по сравнению с исходным равновесным значением, вызванное изменением концентрации потенциалопределяющих ионов в растворе, называется концентрационной поляризацией. Этот вид поляризации наблюдается и в элементе Вольта
Zn |H2SO4| Cu
Электродные реакции в элементе Вольта
А: Zn = Zn2+ + 2ē
K: 2H+ + 2ē = H2
При протекании тока в этом элементе происходит концентрационная поляризация отрицательного электрода, вызванная растворением цинка, а также химическая поляризация медного электрода. Поляризация называется химической в том случае, когда она вызывается изменением химической природы электрода. Так, в элементе Вольта поверхность медного электрода насыщается водородом и образуется "водородный электрод", потенциал которого более низкий, чем потенциал медного электрода.
Поляризация может быть обусловлена и замедленной кинетикой электрохимической реакции окисления и восстановления. Как правило, при работе элемента падение напряжения вызывается рядом причин.
При использовании гальванического элемента, как источника тока, большое значение приобретает процесс устранения поляризации - так называемая деполяризация. Перемешивание раствора уменьшает концентрационную поляризацию. Химическую поляризацию можно устранить, вводя в электролит специальные вещества (деполяризаторы), вступающие в
реакцию с продуктами, обуславливающими поляризацию.
Например, поляризация, вызываемая выделением водорода, снижается под действием специально добавленных окислителей (К2Cr2O7, O2, KMnO4 и др.)
2KMnO4 + 5H2 + 3H2SO4 → 2MnSO4 + K2SO4 + 8H2O
В результате этой реакции поверхность катода очищается от водорода и ЭДС возрастает.
Дата добавления: 2016-12-09; просмотров: 2987;











