Химические источники тока
Для своих нужд в настоящее время человечество использует в основном химическую энергию ископаемого вещества. Химическая энергия превращается в электрическую на паротурбинных тепловых электростанциях и в механическую энергию в двигателях внутреннего сгорания, используемых на транспорте. Т.е. производство электроэнергии станциями, работающими на угле, природном газе, бензине или других подходящих носителях энергии, осуществляется по следующей, ставшей уже классической схеме: химическая энергия топлива – тепловая энергия - энергия движения, электроэнергия. При современных способах преобразования химической энергии топливо используется неэффективно: к.п.д. двигателей внут-
реннего сгорания и электростанций составляет 15 – 40 %. Если бы удалось преобразовывать химическую энергию в электрическую, минуя промежуточные стадии, был бы получен значительный выигрыш как в материалах, так и в энергии. Кроме того, паротурбинные установки и двигатели внутреннего сго-
рания не могут быть использованы во многих областях техники, например: в системах, работающих в космосе и под водой, в портативных устройствах. Существенным недостатком тепловых электростанций и двигателей внутреннего сгорания является то, что они дают большое число вредных выбросов, загрязняют окружающую атмосферу. В связи с этим ведутся поиски новых методов преобразования энергии.
Одним из наиболее перспективных является электрохимический способ преобразования химической энергии в электрическую, которая осуществляется в химических источниках тока. К ним относятся: гальванические элементы, аккумуляторы и топливные элементы. Достоинством их является высокий к.п.д., бесшумность, безвредность, возможность использовать в космосе и под водой, в переносных устройствах на транспорте и т.п.
Гальванические первичные элементы.Гальваническими первичными элементами называют устройство для прямого преобразования химической энергии заключенных в них реагентов в электрическую энергию. Реагенты входят непосредственно в состав гальванического элемента и расходуются в процессе его работы. После расхода реагентов элемент не может больше работать. Таким образом, это источник тока одноразового действия, поэтому его еще называют первичным химическим источником тока. Гальванический элемент характеризуется ЭДС, напряжением, емкостью и энергией, которую он может отдать во внешнюю цепь.
Напряжение элемента U меньше ЭДС из-за поляризации электродов и омических потерь.
U = E - I (r1 + r2) – Δ E,
где Е – ЭДС элемента; I – сила тока; r1 и r2 – сопротивление проводников первого и второго рода внутри элемента; Δ Е – поляризация элемента, равная сумме катодной и анодной поляризаций:
Δ Е = Δ Ек + Δ Еа
В свою очередь катодная и анодная поляризация является суммой концентрационной и электрохимической поляризаций анода и катода.
Поляризация возрастает с увеличением плотности тока. Кроме того, при увеличении плотности тока растет омическое падение напряжения. Таким образом, при увеличении плотности тока напряжение элемента падает.
Емкость элемента – это количество электричества, которое источник тока отдает при разряде. Она определяется количеством запасенных в элементе реагентов, их эквивалентом и степенью превращения. Если элемент разряжается при постоянной силе тока I, то емкость практически определяют по уравнению
CI = I ∙ τ,
где CI – емкость при постоянной силе тока, А; τ – время разряда элемента.
Если элемент разряжается при постоянном внешнем сопротивлении R, то емкость имеет вид:
CR = 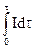 =
= 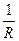
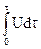
Если элемент разряжается при постоянной силе тока I, то энергию элемента определяют по уравнению
A 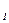 = I
= I 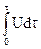
 IU
IU 
и если элемент разряжается при постоянном внешнем сопротивлении R, то по уравнению:
А 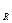 =
= 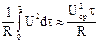 ,
,
где А 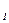 и А
и А 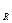 – энергия элемента, которую он отдает во внешнюю цепь, соответственно при постоянной силе тока I или постоянном внешнем сопротивлении R; U
– энергия элемента, которую он отдает во внешнюю цепь, соответственно при постоянной силе тока I или постоянном внешнем сопротивлении R; U 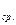 – среднее напряжение при разряде элемента.
– среднее напряжение при разряде элемента.
Важной характеристикой элемента служит удельная энергия, т.е. энергия, отнесенная к единице массы или объема элемента. Так как при увеличении силы тока напряжение элемента падает, то энергия элемента, и удельная энергия также падают. Более высокую удельную энергию можно получить в элементах с большим значением ЭДС, малой поляризацией, малыми значениями электрохимических эквивалентов. В качестве анодов обычно применяют электроды из цинка и магния; катодов – электроды из окислов металлов (марганца, меди, ртути, серебра) и хлоридов (меди и свинца) на графите, а также кислородный электрод.
Широко применяется для питания радиоаппаратуры, аппаратуры связи, магнитофонов, карманных фонарей.
Марганцево - цинковый элемент. Анодом в элементе служит цинковый электрод, катодом – электрод из смеси диоксида марганца с графитом, токоотводом служит графит. В качестве электролита используется паста, состоящая из раствора хлорида алюминия с добавкой муки или крахмала (загустители). Схема элемента: Zn 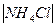 MnO
MnO  , C
, C
На аноде происходит анодное окисление цинка, на катоде Mn (IV) восстанавливается до Mn (III). Суммарное уравнение токообразующей реакции:
Zn + 2NH 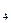 Cl + 2MnO
Cl + 2MnO 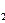 =
= 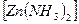 Cl
Cl 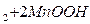
Элемент имеет напряжение 1,4 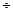 1,6 В, удельную энергию 10 - 50 Вт∙ч/кг. В элементах с такими же реагентами, но со щелочным электролитом (КОН) получают более высокую удельную энергию 20 - 80 Вт∙ч/кг. Если требуется высокая сохранность в рабочем состоянии, постоянное напряжение и высокая удельная энергия на единицу объема, используют ртутно-цинковые элементы:
1,6 В, удельную энергию 10 - 50 Вт∙ч/кг. В элементах с такими же реагентами, но со щелочным электролитом (КОН) получают более высокую удельную энергию 20 - 80 Вт∙ч/кг. Если требуется высокая сохранность в рабочем состоянии, постоянное напряжение и высокая удельная энергия на единицу объема, используют ртутно-цинковые элементы:
Zn 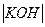 HgO, C
HgO, C
Напряжение элемента 1,0 – 1,3 В, удельная энергия 50 - 130 Вт∙ч/кг. Элементы применяются в портативных радиоприемниках и передатчиках, слуховых аппаратах, кардиостимуляторах.
Напряжение можно увеличить при использовании анодов из магния. Однако такие аноды в водных растворах подвергаются коррозии. Коррозию можно предотвратить применением неводных растворов электролитов, в которых устойчивы даже щелочные металлы. В последние годы разработаны элементы с литиевыми анодами, неводными растворами электролитов (тетрагидрофуран и др.) и катодными материалами на основе оксида марганца, оксида или сульфида или фторида меди (Cu) и др. Такие элементы характеризуются высоким разрядным напряжением (2,0 - 3,0 В) и удельной энергией (200 - 500 Вт ∙ ч/кг).
Аккумуляторы
Это устройства, в которых электрическая энергия превращается в химическую, а химическая – снова в электрическую. В аккумуляторах под воздействием внешнего источника тока накапливается (аккумулируется) химическая энергия, которая затем переходит в электрическую. Процессы накопления химической энергии получили название заряда аккумуляторов, процессы превращения химической энергии в электрическую - разряда аккумулятора. При заряде аккумулятор работает как электролизер, при разряде – как гальванический элемент.
В процессе разряда и заряда изменяется состав активных масс аккумулятора и соответственно Э.Д.С и напряжение. Разрядное напряжение уменьшается, а зарядное напряжение возрастает во времени.
В настоящее время наиболее распространенными являются свинцовые аккумуляторы, в которых в качестве электролита используется раствор H2SO4 (32–39 %, d = 1,24 - 1,30 г/см3), поэтому они еще называются кислотными. Состоит он из решетчатых свинцовых пластин, погруженных в H2SO4. Решетки вначале заполняются оксидом свинца, который при взаимодействии с H2SO4 превращается в PbSO4. Пластины, содержащие губчатый свинец служат анодами (-), а диоксид свинца – катодами (+).
При разряде аккумулятора в нем протекают окислительно-восстановительные реакции:
Анод: Pb + SO 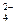 - 2 e
- 2 e 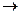 PbSO
PbSO 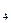 - окисление
- окисление
Катод: PbO  + SO
+ SO 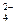 + 4H
+ 4H 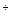 + 2ē
+ 2ē 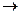 PbSO4+ 2H
PbSO4+ 2H  O –
O –
- восстановление.
Электроны, отдаваемые металлическим свинцом Рb принимаются PbО  при восстановлении. Электроны по внешней цепи передаются от Pb к PbО
при восстановлении. Электроны по внешней цепи передаются от Pb к PbО 
2 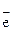
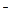 Pb |H
Pb |H  SO
SO 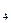 | PbО
| PbО 
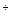

Суммарная реакция в аккумуляторе:
Pb + PbO  + 4H++ 2SO
+ 4H++ 2SO 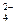 = 2PbSO
= 2PbSO 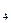 + 2H
+ 2H  O
O
Значение ЭДС аккумулятора равно разности потенциалов электродов и рассчитывается по уравнению:
E = EPbO  / PbSO
/ PbSO 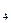 - EPbSO
- EPbSO 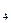 / Pb = E
/ Pb = E 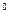 +
+ 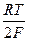 ln
ln 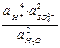 ,
,
где E 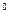 = E
= E  /
/ 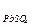 - E
- E 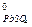 /
/ 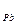 = 1,68 B - (-0,36) B = 2,04 B.
= 1,68 B - (-0,36) B = 2,04 B.
При заряде:
Анод: PbSO 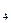 + 2 e
+ 2 e 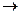 Pb + SO
Pb + SO 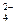
Катод: PbSO 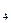 - 2 e + 2H
- 2 e + 2H  O
O 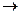 PbO
PbO  + SO
+ SO 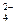 + 4H
+ 4H 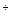
Суммарная реакция:
2 PbSO 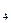 + 2H
+ 2H  O
O 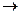 Pb + PbO
Pb + PbO  + 4H
+ 4H 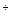 +2 SO
+2 SO 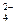
В результате заряда активная масса одного электрода превращается из PbSO 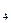 в Pb, а активная масса второго электрода из PbSO
в Pb, а активная масса второго электрода из PbSO 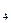 в PbO
в PbO  .
.
При заряде напряжение выше ЭДС и растет в течение заряда. В конце заряда напряжение достигает значения достаточного для электролиза  воды и тогда начинается выделение водорода и кислорода:
воды и тогда начинается выделение водорода и кислорода:
2H 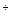 + 2 e
+ 2 e 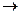 H
H  ; H
; H  O – 2 e
O – 2 e 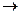
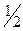 O
O  + 2H
+ 2H 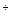
В конце заряда происходит только электролиз воды («кипит»).
При разряде аккумулятора процессы идут в обратном направлении, при этом падает его ЭДС и напряжение. Однако, при напряжении ниже 1,7 В (пл. H  SO
SO 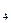 1,17 г/см3) происходит быстрое и необратимое падение напряжения. На электродах образуется неактивная пленка PbSO
1,17 г/см3) происходит быстрое и необратимое падение напряжения. На электродах образуется неактивная пленка PbSO 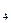 , изолирующая активную массу от электролита. Поэтому ниже, чем 1,7 В разряд производить не следует.
, изолирующая активную массу от электролита. Поэтому ниже, чем 1,7 В разряд производить не следует.
Свинцовый аккумулятор обладает существенными достоинствами: высоким к.п.д. (около 80 %), высокой Э.Д.С. и относительно малым ее изменением при разряде, простотой и невысокой ценой.
Недостатки: невысокая удельная энергия (20 - 30 Вт∙ч/кг), саморазряд аккумулятора при хранении и малый срок службы (2 - 5 лет). Свинцовые аккумуляторы широко используются на электростанциях, телефонных узлах, на железных дорогах, подводных лодках, самолетах, автомобилях, электрокарах и других устройствах.
Кроме кислотных широко применяются и щелочные аккумуляторы. Наиболее распространенные из них никель-кадмиевые и никель - железные аккумуляторы. Положительный электрод содержит гидрооксид никеля, отрицательный электрод - оответственно кадмий или железо. Электролит – 20 - 23,0 % раствор КОН. Суммарные реакции можно записать:
NiOOH + Cd + 2H  O
O 
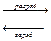 Ni (OH)
Ni (OH)  + Cd (OH)
+ Cd (OH)  ;
;
E 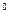 = 1,45 B
= 1,45 B
NiOOH + Fe + 2H  O
O 
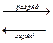 Ni (OH)
Ni (OH)  + Fe (OH)
+ Fe (OH)  ;
;
E 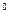 = 1,48 B
= 1,48 B
К достоинствам относится большой срок службы (до 10 лет).
К недостаткам: невысокие к.п.д (60 - 65 %) и Э.Д.С.
Для электромобилей разрабатываются различные аккумуляторы. У свинцовых – из-за малой удельной энергии - малый пробег 60 км. Никель – цинковые – удельная энергия 50 Вт∙ч/кг – 150 км.
Топливные элементы
Разновидностью гальванического элемента является топливный элемент, режим работы которого в отличие от гальванического элемента – непрерывный, так как топливо и окислитель в топливный элемент подаются непрерывно по мере их расходования, а продукты реакции непрерывно отводятся.
Принципиальная схема водородно-кислородного элемента представлена на рис. 63. Топливо окисляется на аноде, отдавая электроны.
2H  + 4OH
+ 4OH 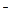 - 4 e = 4H
- 4 e = 4H  O
O
Окислитель принимает их на катоде и восстанавливается:
O  + 2H
+ 2H  O + 4 e = 4OH
O + 4 e = 4OH  .
.
  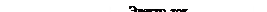 | |||
| |||
Рис. 63. Схема кислородно-водородного топливного элемента
Между анодом и катодом возникает разность потенциалов.
При замыкании внешней цепи электроны перемещаются по ней от анода к катоду, при этом напряжение элемента может достигать от 0,7 до 0,9 В. Общее управление химической реакции в топливном элементе:
H  +
+ 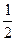 O
O 
 H
H  O
O
Отработанный пар отводится.
Анод - пористый никелево- керамический сплав с включениями никелевой пыли; катод - пористый никелево - керамический сплав с включениями серебряной пыли.
В зависимости от области рабочих температур различают низкотемпературные (до 150 °С), среднетемпературные (170 – 430 °С) и высокотемпературные (500 – 1100 °С) топливные элементы. Давление, при котором находятся рабочие вещества, может быть в пределах 1 - 100 бар. В качестве электролитов используют кислотные и щелочные растворы или ионообменные мембраны (в низкотемпературных элементах), жидкости, расплавы или пасты (в области средних T и p), щелочно - карбонатные расплавы или твердые ионопроводящие материалы (при высоких рабочих температурах).
Для большего повышения скорости реакции на пористые электроды наносят каталитически активные благородные металлы, в частности Pt и Pd. Несмотря на это, проблема электродов удовлетворительно решена только для водородно-кислородных топливных элементов.
В отличие от гальванических элементов топливные элементы не могут работать без вспомогательных устройств. Для увеличения напряжения и тока элементы соединяют батареи. Система, состоящая из батарей топливных элементов, устройств для подвода топлива и окислителя, вывода из элементов продуктов реакции, поддержания и регулирования температуры, получила название электрохимического генератора. К настоящему времени созданы электрохимические генераторы, мощностью от десятков ватт до тысячи киловатт. Удельная энергия их выше удельной энергии гальванических элементов. Наиболее разработаны кислородно-водородные генераторы, которые уже применяются на космических кораблях. Они обеспечивают космический корабль и космонавтов не только электроэнергией, но и водой, которая является продуктом горения в топливном элементе.
Дата добавления: 2016-12-09; просмотров: 2291;











