Химическая коррозия
Внешние факторы газовой коррозии. Газовая коррозия является частным случаем химической коррозии и возможна только в условиях, исключающих протекание электрохимических процессов. Характерной особенностью газовой коррозии является отсутствие на поверхности металла влаги. Поэтому в большинстве случаев речь идет о коррозии при повышенной температуре, при которой вода находится в газовой фазе. Однако, исходя из определения, можно представить себе газовую коррозию и при комнатной температуре, но в условиях высокой степени сухости, естественной или создаваемой искусственно. Так, при осушении силикагелем до точки росы – 30 °С влагоемкость воздуха составит 0,333 г/м3. При + 20 °С это соответствует влажности воздуха всего лишь 2 %. В таких усло-
виях протекание электрохимической коррозии практически исключается. В промышленности случаи газовой коррозии встречаются достаточно часто - от разрушения деталей, нагревательных печей до коррозии металла в процессе его термической обработки.
На скорость газовой коррозии влияет целый ряд факторов, и прежде всего такие, как температура и состав газовой среды.
Повышение температуры заметно увеличивает скорость коррозии. В первом приближении эта связь может быть описа-
на известным из физической химии уравнением Аррениуса
ln K = A - 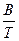
где К - скорость реакции; А и В - константы; Т - абсолютная температура (°К).
Из уравнения следует, что логарифм скорости коррозии линейно связан с величиной, обратной абсолютной температуре. Эта зависимость в некоторых случаях (например, для меди в интервале температуры 700 – 900 °С) полностью подтверждается, но чаще она носит более сложный характер, что связано с влиянием вторичных реакций, природой и свойствами продуктов коррозии и др.
В среде чистого воздуха коррозия сводится к взаимодействию металла с кислородом. Железо уже при температуре 300 °С покрывается на воздухе окалиной, т. е. окисной пленкой, различимой невооруженным глазом. В состав окалины входит магнетит F3O4 и гематит Fe2O3. С ростом температуры, вплоть до 575 °С, скорость коррозии остается примерно постоянной, но, начиная с 575 0С, резко увеличивается. Этот факт связывают с появлением на границе металл - окалина вюстита (окиси железа FеО).
На поверхности углеродистой стали в процессе коррозии параллельно протекают две группы реакций: окисление железа до окислов с образованием окалины и реакции обезуглероживания c участием карбида железа (цементита) по следующему уравнению:
Fe3C + O2 → 3Fe + CO2.
Таким образом, поверхностный слой металла обедняется цементитом. При длительном нагреве глубина обезуглероженного слоя может составлять несколько миллиметров. Это заметно влияет на свойства металла, и прежде всего на его твердость и прочность. Обезуглероживание наблюдается и при наличии в газовой среде углекислого газа, паров воды или других окислителей и протекает по аналогичным реакциям:
Fe3C + СО2 → 3Fе + 2СО,
Fe3C + Н2O → 3Fe + СО + Н2.
Повышение давления газа при прочих равных условиях также сильно ускоряет газовую коррозию.
Специфично влияет на коррозионную стойкость стали водород, вызывая при повышенной температуре и давлении так называемую водородную хрупкость, т. е. резкое снижение прочности. Водородная хрупкость объясняется не только обезуглероживанием стали за счет восстановления цементита водородом, но и такими явлениями, как молизация атомарного водорода, находящегося в кристаллической решетке стали, и образование по границам зерен металла паров воды и метана. Каждый из процессов приводит к генерированию газа, создающего в замкнутом объеме металла колоссальное давление. Это в свою очередь вызывает появление многочисленных микротрещин, понижающих прочность металла.
Газовой коррозии сильно подвержены и многие цветные
металлы, хотя каждый из них относится к тем или иным газам поразному. Это можно проиллюстрировать данными табл. 2, в которой скорость коррозии металлов для наглядности дана в относительных единицах, при этом скорость коррозии железа в кислороде принята за 100.
Табл. 9 убедительно демонстрирует влияние природы металла на скорость коррозии. Например, если при переходе от кислорода к парам воды коррозия вольфрама замедляется примерно в 20 раз, а меди - в 3,5 раза, то скорость коррозии железа при этом, наоборот, увеличивается.
Таблица 9
Газовая коррозия ряда металлов в некоторых средах
(температура 800 °С, продолжительность 24 ч)
| Металл | О2 | Н2O | СО2 |
| Железо | |||
| Медь | 23,4 | 6,5 | 12,7 |
| Никель | 1,9 | 0,06 | 0,8 |
| Вольфрам | 4,1 | 27,2 |
Окисные пленки.Существенное влияние на скорость газовой коррозии оказывают образующиеся продукты коррозии, их физико - химические и механические свойства. В большинстве случаев коррозия протекает в окислительной среде; при этом на поверхности металла в качестве продукта коррозии образуется окисная пленка. Впрочем, тонкая окисная пленка на металле обычно появляется уже при комнатной температуре. Свойства образующейся окисной пленки решающим образом влияют на дальнейший ход коррозионного процесса. В случае резкого торможения процесса вплоть до полного прекращения коррозии говорят о наступившей пассивности поверхности металла.
Термодинамика газовой коррозии. Термодинамическая возможность процесса газовой коррозии с образованием окисной пленки определяется величиной изменения свободной энергии системы. Существует удобная форма определения термодинамической возможности протекания коррозии за счет окисления металла, которая сводится к сравнению упругости диссоциации полученного продукта реакции окисления с парциальным давлением кислорода в газовой фазе.
Действительно, если парциальное давление кислорода РO 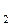 и упругость диссоциации окисла РMeO в реакции окисления металла mМе + nO2
и упругость диссоциации окисла РMeO в реакции окисления металла mМе + nO2 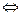 МеmO2n будут равны, то реакция будет находиться в равновесии. Если РO
МеmO2n будут равны, то реакция будет находиться в равновесии. Если РO 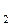 > РMeO, то реакция протекает слева направо в сторону образования окисла. Если РO
> РMeO, то реакция протекает слева направо в сторону образования окисла. Если РO 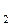 < РMeO, то окисел самопроизвольно диссоциирует на кислород и металл. Поэтому сравнение упругости диссоциации данного окисла при данной температуре, например, с парциальным давлением кислорода воздуха (РO
< РMeO, то окисел самопроизвольно диссоциирует на кислород и металл. Поэтому сравнение упругости диссоциации данного окисла при данной температуре, например, с парциальным давлением кислорода воздуха (РO 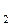
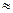 0,2 ат при атмосферном давлении) позволяет найти границу термодинами
0,2 ат при атмосферном давлении) позволяет найти границу термодинами
ческой вероятности процесса окисления металла на воздухе. Так, судя по данным табл. 10, серебро уже при 400 °К не способно окисляться. Для меди эта граница лежит в области 2000 °К.
Таблица 10
Упругость диссоциации окислов серебра и меди
в зависимости от температуры
| Процесс | 300 0К | 400 0К | 500 0К | 800 0К | 12000К | 16000К |
Ag2O 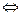 2Ag + 2Ag + 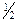 O2 O2
| 8,4 ∙ 10-5 | 6,9 ∙ 10-1 | - | - | - | |
Cu2O 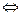 2Cu + 2Cu + 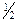 O2 O2
| - | - | 0,56 ∙ 10-30 | 3,7 ∙ 10-16 | 2 ∙ 10-8 | 1,8 ∙ 10-4 |
Свойства окисных пленок. В зависимости от условий образования окисные пленки могут иметь толщину от мономолекулярной до нескольких миллиметров. Различаются тонкие, средние и толстые пленки. Тонкие пленки имеют толщину от нескольких ангстрем до 400 Å. Они невидимы и могут быть обнаружены и измерены так называемым оптическим методом отражения поляризованного света.
Средние пленки имеют толщину 400 - 5000 Å и видны невооруженным глазом благодаря возникновению цветов побежалости (явление интерференции света, известное из физики). Их толщина может быть измерена различными методами, среди которых наиболее доступные гравиметрический (весовой) и электрометрический (метод катодного восстановления).
Пленки толщиной выше 5000 Å (т. е. толще 0,5 мк) определяются весовым методом или методом катодного восстановления, а также с помощью микроскопа, микрометра или других аналогичных мерительных инструментов. Обычно они легко обнаруживаются невооруженным глазом.
Следует отметить, что при изучении фазового состава и
структуры окисных пленок широко используются электронно-микроскопический, электронно-графический и рентгенографический методы исследования.
В табл. 11 даны примеры окисных пленок на железе. Обращает на себя внимание четкая зависимость толщины пленки от условий ее образования, а также сам диапазон толщины - от 15 Å до 0,6 мм.
Было бы ошибочным считать, что чем толще окисная пленка, тем она надежнее защищает металл от коррозии. В действительности дело обстоит скорее наоборот, а именно лучшими защитными свойствами обладают тонкие пленки. Однако толщина пленки, строго говоря, не является все же критерием защитной способности.
Чтобы окисная пленка обладала защитными свойствами, она должна быть прежде всего сплошной, беспористой. Условие сплошности окисной пленки было сформулировано Пиллингом и Бедворсом: если объем окисла металла меньше, чем объем металла, из которого пленка образовалась, то пленка
образуется несплошной; если объем окисла металла больше, чем объем металла, то пленка может быть беспористой, компактной.
Сказанное можно пояснить следующими неравенствами:
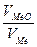 < 1 пленка не может быть сплошной; при
< 1 пленка не может быть сплошной; при 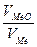 > 1 пленка может быть сплошной.
> 1 пленка может быть сплошной.
В свою очередь
VMe = 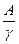 и VMeO =
и VMeO = 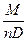 ,
,
где А - атомный вес металла (т. е. рассматривается грамм - атом металла); 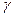 - плотность металла; М - молекулярный вес
- плотность металла; М - молекулярный вес
окиси металла; n - число атомов металла в молекуле окиси; D - плотность окиси.
Таблица 11
Толщина окисной пленки на железе
в зависимости от условий
| Условия образования пленки | Толщина пленки, A | Категория пленки | Цвета побежалости |
| Сухой воздух при 20 °С | 15 - 25 | Тонкая | - |
| Нагревание на воздухе при 400 °С в течение: 1 минуты 2 минут 3 минут | } Средние | Желтый Красный Синий | |
| Нагревание на воздухе при 900 °С в течение 7 суток | 0,6 мм | Толстая | - |
Условие сплошности является необходимым и существенным, но не единственным для характеристики защитных
свойств окисной пленки. При слишком больших значениях VМеO / VМе плёнка испытывает столь высокие внутренние напряжения, что разрушается, теряя сплошность. Например, при отношении VWO 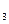 / VW = 3,35 окисная пленка вольфрама имеет весьма слабые защитные свойства.
/ VW = 3,35 окисная пленка вольфрама имеет весьма слабые защитные свойства.
Пленка должна иметь хорошее сцепление с металлом, должна быть достаточно прочной и эластичной. Коэффициенты теплового расширения пленки и металла должны быть достаточно близки. Наконец, пленка должна быть химически стойкой в условиях воздействия на нее коррозионной среды.
Важным условием является и необходимость ориентаци-
онного соответствия образующейся пленки металлу. Сущность ориентационного соответствия сводится к требованию максимального сходства кристаллических решеток металла и образующегося окисла при минимальном смещении атомов. Чаще всего при наличии кристаллической структуры окисла, близкой структуре металла, защитные свойства такой пленки лучше, чем неориентированного по отношению к металлу окисла.
Законы роста окисных пленок. Если в результате коррозии образуется несплошная окисная пленка, кислород получает свободный доступ к поверхности металла. В этом случае скорость коррозии должна быть величиной постоянной:
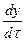 = к,
= к,
где y - толщина окисной пленки. После интегрирования получим уравнение
y = k 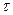 + А,
+ А,
выражающее линейную зависимость толщины пленки от времени. Постоянная А указывает на наличие некоторой окисной пленки к моменту начала окисления (у = А при 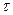 = 0). Как следует из уравнения, скорость роста пленки в этом случае не зависит от ее толщины. Коррозия может протекать с постоянной скоростью вплоть до полного превращения металла в окисел, как это имеет место при окислении магния в среде кислорода.
= 0). Как следует из уравнения, скорость роста пленки в этом случае не зависит от ее толщины. Коррозия может протекать с постоянной скоростью вплоть до полного превращения металла в окисел, как это имеет место при окислении магния в среде кислорода.
Однако нередко фактическая скорость окисления, сохраняя постоянство, оказывается ниже теоретической скорости химической реакции окисления металла. Это несоответствие объясняется наличием на границе раздела металл - окисел металла тончайшей, вплоть до нескольких мономолекулярных слоев, сплошной пленки псевдоморфного окисла. Псевдоморфный окисел обладает высокой степенью ориентационного соответствия металлу и является, таким образом, своеобразным кристаллографическим продолжением решетки окисляемого металла, отличаясь в то же время по параметрам от решетки окисла металла. Будучи беспористым, он затрудняет проникновение кислорода к поверхности металла.
Таким образом, даже в случае образования на металле толстой и рыхлой окисной пленки скорость коррозии в конечном итоге будет лимитироваться не скоростью реакции окисления, а скоростью диффузии кислорода сквозь компактный псевдоморфный окисел.
Если в процессе коррозии образуется окисел, обладающий достаточно хорошими защитными свойствами, то скорость коррозии будет зависеть от соотношения скоростей взаимной диффузии сквозь пленку атомов кислорода к поверхности металла и атомов металла к поверхности раздела фаз окисел - газ. Можно показать, что в этом случае по мере роста толщины пленки скорость коррозии будет замедляться по уравнению
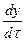 =
= 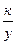
После интегрирования и объединения констант получаем параболическую зависимость толщины окисной пленки от продолжительности коррозии:
y2 = k 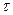 + А.
+ А.
Такая зависимость наблюдается при окислении меди, никеля, вольфрама. Имея параболическую кривую зависимости коррозии от времени, можно определить скорость коррозии в любой точке кривой. Она будет выражаться как тангенс угла наклона касательной, проходящей через данную точку, так как
tg 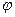 =
= 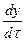 .
.
Наконец, в некоторых условиях торможение скорости окисления металла с ростом толщины окисной пленки происходит более интенсивно, чем этого требует параболический закон. В этих случаях скорость окисления связана с толщиной пленки экспоненциальной зависимостью
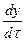 =
= 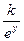
После интегрирования приходим к логарифмическому уравнению
у = ln (k 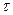 ).
).
Логарифмический закон роста пленки имеет экспериментальное подтверждение при окислении на воздухе алюминия и цинка в интервале температуры 20 – 255 °C, меди - до 100 °С, железа до 385 °С.
Важно подчеркнуть, что закономерности роста пленки на металле могут меняться в зависимости от условий. Так, окисление железа при температуре ниже 385 °С подчиняется логарифмическому закону, в области выше этой температуры и до 1000 °С - параболическому, а при давлении кислорода ниже 1 мм рт. ст. и температуре 700 - 950 °С - линейному.
Разрушение пленок. В процессе роста окисной пленки в ней возникают значительные внутренние напряжения. Поэтому, если образующаяся пленка недостаточно прочна или имеет слабое сцепление с металлом, или слишком неэластична, или по другим причинам, затронутым выше (например, различие коэффициентов температурного расширения металла и пленки), она разрушается. Характер разрушения связан с причиной, вызвавшей его. Если прочность пленки велика, а сцепление с металлом недостаточно хорошее, образуются пузыри. Крупные пузыри приводят обычно к разрывам (рис. 68, а), и защитные
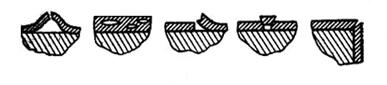
а б в г д
Рис 68. Виды разрушения окисных пленок.
а - пузырь с разрывом; б - микропузыри в слое окисла (вакуумная пористость); в - отслаивание; г - растрескивание при
сдвиге; д - растрескивание на углах и ребрах.
свойства пленки резко снижаются. В других случаях образуются мелкие пузыри в слое окисла (рис. 68, б), и тогда защитные свойства пленки могут даже возрасти, так как подобная «вакуумная пористость» препятствует диффузии реагирующих атомов или ионов и таким образом тормозит процесс коррозии. Может наблюдаться отслаивание окисла (рис. 68, в), а также растрескивание на поверхности (рис. 68, г) или на углах и ребрах (рис. 68, д).
Методы защиты от газовой коррозии.Основной метод защиты от газовой коррозии сводится к применению легированных сплавов, обладающих так называемой жаростойкостью. Для снижения скорости окисления железа при 900 °С вдвое достаточно ввести 3,5 % алюминия, а вчетверо - около 5,5 %. Концентрация легирующего компонента может быть ничтожной. Так, расплавленный магний настолько энергично окисляется на воздухе, что способен самовозгораться. Однако при введении всего лишь 0,001 % бериллия скорость окисления магния резко снижается.
Действие легирующих элементов объясняется образованием на поверхности металла защитных пленок. Они или образуются только из легирующего компонента, или состоят из смешанных окислов легирующего компонента и основного металла. Наилучшими защитными свойствами обладают окислы типа шпинелей. Шпинельная структура окисла характеризуется высокой степенью компактности ионов в решетке и практическим отсутствием вакантных узлов; это и обусловливает их высокую термодинамическую стабильность. Примером шпинелей являются окислы FeO ∙ Сr2О3 на поверхности хромистой стали или NiO ∙ Сr2О3 на поверхности хромо - никелевой стали.
Второй метод борьбы с газовой коррозией - применение защитной атмосферы. В зависимости от природы металла газовая среда не должна содержать окислителей (для стали) или, наоборот, восстановителей (для меди). В ряде случаев применяются инертные газы - азот, аргон. На практике этот метод встречается только в специальных случаях: при термообработке и сварке. Так, отжиг стали проводят в атмосфере, содержащей смесь азота, водорода и окиси углерода. Сварка алюминиево-магниевых и титановых деталей протекает успешно в атмосфере аргона.
Третий метод снижения скорости газовой коррозии - защита поверхности металла специальными жаростойкими по
крытиями. В одних случаях поверхность, например стальной детали покрывают термодиффузионным способом сплавом железо - алюминий или железо - хром. Оба сплава обладают высокими защитными свойствами, а сам процесс называется
соответственно алитированием и термохромированием. В других случаях поверхность защищают слоем кермета - смесью металла с окислами. Керамико - металлические покрытия (керметы) интересны тем, что сочетают тугоплавкость, твердость и жаростойкость керамики с пластичностью и проводимостью металла. В качестве неметаллической составляющей используют тугоплавкие окислы Al2O3, MgO и соединения - типа карбидов и нитридов. Металлическим компонентом служат металлы группы железа, а также хром, вольфрам, молибден.
Дата добавления: 2016-12-09; просмотров: 3055;











