И направление реакций
Влияние кислотности среды.Характер окислительно-восстановительного процесса во многом зависит от кислотности среды, в которой он происходит.
Например, реакция
H2SeO4 + 2НСl = H2SeO3 + Cl2 + Н2O
в кислой среде протекает слева направо, а в щелочной – справа налево.
Иногда среда может усилить или ослабить окислительно-восстановительную функцию соединения. Это можно проследить на взаимодействии перманганата калия с сульфитом натрия:
а) кислая среда
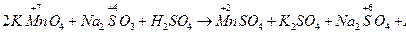 H2O
H2O
 MnO4- + 8H+ + 5
MnO4- + 8H+ + 5  = Mn2+ + 4H2O 2
= Mn2+ + 4H2O 2
 SO32- + H2O - 2
SO32- + H2O - 2  = SO42- + 2H+ 5
= SO42- + 2H+ 5
2MnO4- + 16H+ + 5SO32- +5H2O = 2Mn2+ + 8H2O + 5SO42- + 3H2O
6H+ 10H+ + 3H2O
2MnO4- + 6H+ + 5S32- = 2Mn2+ + 3H2O + 5SO42-
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + K2SO4 + 5Na2SO4 + 3H2O
б) нейтральная среда
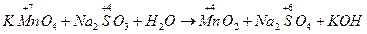
 МnO4- + 2Н2O + 3
МnO4- + 2Н2O + 3  = МnO2 + 4OН- 2
= МnO2 + 4OН- 2
2SO32- + Н2O - 2  = SO42- + 2Н+ 3
= SO42- + 2Н+ 3

2MnO4- + 4Н2O+ 3SO32- + ЗН2O = 2MnO2 + 8OН- + 3SO42-+6H+
Н2O 2OН-
2MnO4- + 3SO32- + Н2O = 2MnO2 + 3SO42- + 2OН-
2KMnO4 + 3Na2SO3 + Н2O = 2MnO2 + 3Na2SO4 + 2КOН
в) щелочная среда

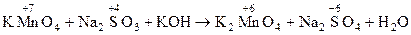 МnO-4 +
МnO-4 +  = МnO2-4 2
= МnO2-4 2
 SO32- + 2OН--2ё = SO42- + Н2O 1
SO32- + 2OН--2ё = SO42- + Н2O 1
2MnO4- + SO32- + 2OН- = 2MnO4- + SO42- + Н2O
2KMnO4 + Na2SO3 + 2КОН = K2MnO4 + Na2SO4 + Н2O
Из приведенных реакций видно, что в кислой среде окислительные свойства КМnO4 проявляются наиболее полно (Мn+7 восстанавливается до Мn+2). В меньшей степени окислительные свойства КМnO4 проявляет в нейтральной и щелочной
среде (Мn+7 восстанавливается до Мn+6).
Влияние температуры и концентрации.Кроме кислотности среды на характер и направление окислительно-восстановительных реакций влияют температура и концентрация реагирующих веществ.
Например, при взаимодействии хлора со щелочью обнаруживается одновременное влияние этих двух факторов. Если газообразный хлор пропускать через концентрированный раствор горячей щелочи, то реакция пойдет по уравнению:
3С12 + 6NaOH = NaClO3 + 5NaCl + 3H2O
При взаимодействии хлора с холодным и разбавленным раствором щелочи протекает иная реакция:
Сl2 + 2NaOH = NaClO + NaCl + Н2O
Во многих случаях температура определяет направление процесса. В полупроводниковой технике широко применяется иодидный способ получения чистейшего кремния, который основан на обратимой реакции:
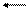
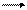 Si + 2I2 SiI4
Si + 2I2 SiI4
Равновесие реакции при 750 - 850 °С практически полностью сдвинуто в сторону образования SiI4. При повышении температуры до 1000 - 1200 °С происходит термическая диссоциация тетраиодида кремния.
Дата добавления: 2016-12-09; просмотров: 1578;











