Классификация окислителей и восстановителей
Окислительно-восстановительные свойства атомов различных элементов и образуемых ими соединений зависят от положения этих элементов в периодической системе Д.И. Менделеева.
Элементы и их соединения, участвующие в окислительно-восстановительных реакциях, можно отнести к одной из трех групп:
I - безусловные восстановители;
II - безусловные окислители;
III - в зависимости от условий могут быть и окислителями и восстановителями.
I группа. Только восстановителями могут быть:
а) свободные атомы металлов всех семейств (s-, р-, d- и f) и металлы в конденсированном состоянии;
б) элементы в форме существования с наиболее отрицательным окислительным числом.
Проявление свободными металлами только восстановительных свойств объясняется способностью их атомов терять полностью или частично валентные электроны. Свободные атомы металлов способны отдавать столько электронов (максимально) каков номер группы. Na+1; Са+2; Мп+7.
Восстановительная активность металлов проявляется по-разному. Мерой её для свободных атомов металлов является потенциал ионизации (I), а в водных растворах - электродный потенциал (Е). Самыми энергичными восстановителями в соответствии со значениями I и Е являются щелочные металлы, а самыми пассивными - переходные металлы VII периода (Hf, Та, W, Re).
Только восстановителями могут быть и атомы неметаллических элементов с отрицательным окислительным числом, например элементы IV А - VII А подгрупп в 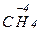 ,
, 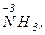
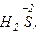
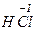 и других соединениях, а также ион Н-1 (гидрид-анион). В ряду сходных водородных соединений неметаллов HF, НСl, НВr и HI их восстановительная функция усиливается в том направлении, которое соответствует уменьшению электроотрицательности неметалла. HI - сильный восстановитель, a HF - в
и других соединениях, а также ион Н-1 (гидрид-анион). В ряду сходных водородных соединений неметаллов HF, НСl, НВr и HI их восстановительная функция усиливается в том направлении, которое соответствует уменьшению электроотрицательности неметалла. HI - сильный восстановитель, a HF - в
водных растворах восстановленные свойства не проявляет.
II группа. Только окислителями могут быть атомы элементов с наивысшим положительным окислительным числом в соединениях, а также атомы и молекулы фтора и кислорода (за исключением соединений фтора с кислородом).
Атомы с максимальным окислительным числом содержатся в высших оксидах и их производных - гидроксидах и солях: 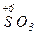 ,
, 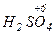 ,
, 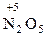 ,
, 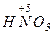 ,
, 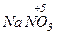 . Окислительная способность оксидов, как правило, выше, чем у соответствующих гидроксидов и особенно солей
. Окислительная способность оксидов, как правило, выше, чем у соответствующих гидроксидов и особенно солей
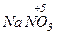 ,
, 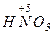 ,
, 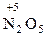 ,
,
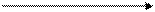
В этом ряду окислительная способность возрастает.
Слабыми окислителями являются катионы щелочных и щелочно-земельных металлов. В отличие от них сильными окислителями являются катионы пассивных металлов (Bi3+, Сu2+, Ag+, Аu3+). Это свойство используется, например, при изготовлении печатных плат, химическое меднение которых проводят восстановлением ионов Сu2+ (из растворов комплексных соединений) формальдегидом.
III группа. Некоторые вещества в реакциях окисления-восстановления могут выступать и окислителями, и восстановителями (в зависимости от условий). Ими могут быть:
а) Атомы и молекулы неметаллов IV А - VII А подгрупп, бор, водород;
H-1 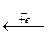 H0
H0 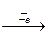 H+1
H+1
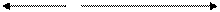 S-2
S-2 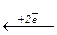 S0
S0 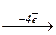 S+4
S+4 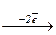 S+6
S+6
|
|
б) Ионы элементов с промежуточным (между низшим и высшим) положительным окислительным числом в соединении.
Например, для марганца окислительными числами могут быть: Мn0, 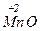 ,
, 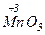 ,
, 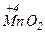 ,
, 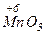 ,
, 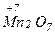 . Все формы его соединений с О.Ч. +2, +3, +4, +6 в зависимости от условий могут проявлять как окислительные, так и восстановительные функции.
. Все формы его соединений с О.Ч. +2, +3, +4, +6 в зависимости от условий могут проявлять как окислительные, так и восстановительные функции.
в) Перекисные соединения (Н2О2, ВаО2 и др.).
Это связано со способностью соответствующих элементов отдавать или принимать электроны, повышая или понижая своё окислительное число. Двойственный характер поведения, например, Н2О2 обусловлен природой связи. Атомы кислорода связаны друг с другом единичной неполярной ковалентной связью. Так как при этом общая пара электронов симметрично расположена относительно обоих ядер, то данная связь не изменяет окислительного числа атомов кислорода. Зато полярная ковалентная связь атомов кислорода с водородом обеспечивает О.Ч. -1 каждому кислородному атому.
С одной стороны, молекула Н2О2 может распадаться с разрывом кислородной связи и образованием новых связей кислорода с атомами других элементов, в результате О.Ч. кислорода уменьшается до -2. При таком превращении перекись ведет себя как окислитель: 2Н+ + Н2O2-1 + 2 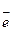 → 2Н2O-2.
→ 2Н2O-2.
С другой стороны в Н2O2 могут разрываться связи О-Н, в результате образуются молекулы O2 и О.Ч. кислорода повышается до 0. В этом случае Н2O2 проявляет восстановительные свойства.
Во многих реакциях, протекающих в водных растворах, участвуют соединения, атомы которых не изменяют О.Ч. Такие вещества в окислительно-восстановительных процессах вводят для создания среды: нейтральной, щелочной и кислотной.
Дата добавления: 2016-12-09; просмотров: 5359;











