Гальванические элементы
Гальваническими элементами называются устройства, в которых химическая энергия окислительно-восстановительной реакции превращается в электрическую. Гальванический элемент состоит из 2-х металлических электродов, помещённых в раствор электролитов, т.е. из 2-х полуэлементов.
Рассмотрим работу гальванического элемента, составленного из 2-х полуэлементов Zn2+ / Zn и Cu2+ / Cu, т.е. медная пластина погружена в раствор CuSO4, и цинковая пластина – в ZnSO4. (рис.61). Для предотвращения прямого воздействия и взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой. На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие Zn 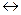 Zn2+ + 2ē. В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие Cu
Zn2+ + 2ē. В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие Cu 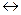 Cu2+ + 2 ē. В результате возникает электродный потенциал меди. Потенциал цинкового электрода отрицательнее потенциала медного электрода (E
Cu2+ + 2 ē. В результате возникает электродный потенциал меди. Потенциал цинкового электрода отрицательнее потенциала медного электрода (E 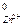 /
/ 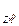 =-0,76В < Е
=-0,76В < Е 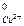 /
/ 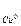 =+0,34В).
=+0,34В).
При замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, вследствие разности потенциалов часть электронов с цинковой пластинки перейдёт на медную.
Это нарушит равновесие в двойном электрическом слое у цинка. Обе системы стремятся снова к равновесию за счёт окисления цинка и восстановления катионов меди на медном электроде. Этими процессами сохраняется разность потенциалов пластинок, обеспечивающая постоянный переход электро-
 |
Рис. 61. Схема гальванического элемента Якоби – Даниэля.
нов по проволоке от цинка к меди – электрический ток в цепи. Во внутреннем участке цепи анионы SО 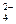 перемещаются от медного электрода к цинковому, а катионы цинка Zn2+ и меди Сu2+ - в обратном направлении. Суммарный процесс выражается тем же уравнением реакции Zn + CuSO4 = ZnSO4 + Cu, что и при непосредственном взаимодействии окислительно - восстановительных систем Zn2+ / Zn и Cu2+ / Cu0.
перемещаются от медного электрода к цинковому, а катионы цинка Zn2+ и меди Сu2+ - в обратном направлении. Суммарный процесс выражается тем же уравнением реакции Zn + CuSO4 = ZnSO4 + Cu, что и при непосредственном взаимодействии окислительно - восстановительных систем Zn2+ / Zn и Cu2+ / Cu0.
Электрический ток в гальваническом элементе возникает за счёт окислительно - восстановительной реакции, протекающей так, что окислительные и восстановительные процессы оказываются пространственно разделёнными: на положительном электроде происходит процесс восстановления, на отрицательном - процесс окисления. Электрод, на котором происходит процесс восстановления, называется катодом (Cu), окисления - анодом (Zn).
Необходимое условие работы гальванического элемента - разность потенциалов электродов, которая называется электродвижущей силой гальванического элемента – ЭДС или ε.
ЭДС элемента считается положительной, если токообразующая реакция в данном направлении протекает самопроизвольно. Положительной ЭДС отвечает и определённая услов-
ность в значении схемы элемента. Она заключается в том, что записанный слева электрод должен быть отрицательным. Например, элемент Даниэля - Якоби схематически изображается так:
(-) Zn |ZnSO4| |CuSO4| Cu (+)
Двойная черта указывает на то, что диффузионный потенциал между растворами ZnSO4 и CuSO4 устранён. Это достигается применением промежуточного насыщенного раствора KCl или KNO3 с одинаковой подвижностью катионов и анионов. ЭДС элемента определяется разностью электродных потенциалов меди и цинка, т.е. ЭДС = Е 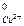 /
/ 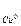 - E
- E 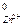 /
/ 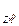
ЭДС = Е Cu – Zn = 0,34 - (- 0,76) = 1,1 (В), если концентрация ионов цинка и меди равна 1 г – ион / л.
Если на электродах испытывает превращение один г – экв. вещества, то по закону Фарадея через систему протекает один фарадей электричества, при превращении одного моля вещества - n фарадеев электричества, равное числу грамм - эквивалентов в одном моле вещества. Таким образом, максимальная электрическая работа гальванического элемента при превращении одного моля вещества Aэр равна
Aэр = nFE,
где Е - Э.Д.С. гальванического элемента.
С другой стороны, максимальная полезная работа Амр, которую может совершить система при протекании реакции (p = const), равна энергии Гиббса реакции:
Aмp = - Δ G
Так как Aэp = Aэр, то получим
Е = - Δ G / nF
Для реакции, протекающей в элементе Даниэля – Якоби
Zn + CuSO4 = ZnSO4 + Cu
Изменение свободной энергии в стандартных условиях равно -51,85 ккал (-216946 Дж); подставляя эту величину получим:
Е = - 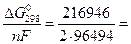 1,1 В.
1,1 В.
Эта величина совпадает с ЭДС, вычисленной по разности стандартных потенциала меди и цинка.
Таким образом, главный критерий возможности самопроизвольного течения реакции в данном направлении - положительное значение вычисленной ЭДС соответствующего элемента.
Прямым измерением разности потенциалов на клеммах гальванического элемента при помощи обычного вольтметра можно получить значение напряжения U, которое не равно ЭДС элемента: U < ЭДС, что обусловлено падением напряжения внутри элемента и другими эффектами. Поэтому измерение ЭДС обычно проводят компенсационным методом, при котором сила тока, протекающего через элемент, близка к нулю. Для этого к элементу подводят ЭДС с противоположным знаком от внешнего источника тока, значение которой можно регулировать тем или иным способом. В измерительную цепь включают также гальванометр для регистрации тока и вольтметр для измерения напряжения. В момент, когда выходное напряжение внешнего источника тока равно ЭДС гальванического элемента (момент компенсации ЭДС), сила тока в цепи равна нулю (стрелка гальванометра не отклоняется). Измеренное в этот момент напряжение на клеммах гальванического элемента равно его ЭДС. Менее точный метод измерения ЭДС может быть использован с помощью высокоомного вольтметра, при измерении которым мала сила тока, протекающего через элемент, поэтому невелика разница между ЭДС и напряжением элемента.
Дата добавления: 2016-12-09; просмотров: 2933;











