Строение двойного электрического слоя
Если в воду (или раствор электролита) погрузить пластинку какого-либо металла, то на его поверхности возникают процессы, приводящие к образованию так называемого двойного электрического слоя.
Ионы металла из его кристаллической решетки под влиянием полярных молекул воды отрываются и переходят в воду (или раствор). При этом поверхность металла заряжается отрицательно за счёт оставшихся в металле электронов, а слой воды заряжается положительно за счёт ионов, которые перешли в
раствор. В результате на границе Ме - раствор устанавливается равновесие Ме2+ (металл)  Ме2+(раствор), т.к. по мере увеличения заряда пластинки переход катионов в одноимённо заряженный раствор затрудняется. Если при установлении контакта металл-раствор скорость перехода катионов из металла в раствор была меньше, чем скорость их перехода в обратном
Ме2+(раствор), т.к. по мере увеличения заряда пластинки переход катионов в одноимённо заряженный раствор затрудняется. Если при установлении контакта металл-раствор скорость перехода катионов из металла в раствор была меньше, чем скорость их перехода в обратном
направлении, то между электроном и раствором также устанавливается равновесие; но в этом случае электрод заряжается положительно, а раствор - отрицательно. Таким образом, происходит образование двойного электрического слоя, который может иметь различные заряды. Рассмотрим подробнее, от чего это зависит и как количественно можно охарактеризовать двойной электрический слой.
Электродные потенциалы. Заряд иона относительно велик, а электрическая ёмкость на границе между металлом и раствором мала, поэтому уже при переходе очень малого количества ионов между металлом и раствором возникает значительная разность потенциалов. Например, при переходе ионов серебра в количестве одной стомиллионной доли грамма (10-8 г) из раствора в металл его потенциал становится положительнее на 0,5 В.
Таким образом, двойной электрический слой можно уподобить конденсатору, одна из обкладок которого представляет собой поверхность металла, а другая - слой ионов в растворе у поверхности металла. Между разноимённо заряженными обкладками и возникает разность, или скачок потенциала.
Различают три случая возникновения скачка потенциала на границе металл - раствор электролита.
I. Ионы металла, находящиеся на поверхности обладают избыточной энергией по сравнению с энергией частиц, находящихся внутри металла. Взаимодействие полярных молекул воды с поверхностью металла приводит к отрыву катионов металла в виде гидратированных ионов
Ме + mН2О  Меn+ (Н2О)m + n
Меn+ (Н2О)m + n 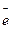
В этом случае поверхность металла заряжается отрицательно (-), а слой электролита, примыкающий к ней - положительно (+). Образуется двойной слой с определённой разностью потенциалов.

 |
а б
Рис. 59. Двойной электрический слой (а) и падение потенциал в нём (б); l1-адсорбционный слой; l2-диффузионный слой
Катионы распределяются следующим образом: часть ионов плотно прилегает к поверхности металла (ионы находятся на расстояни радиуса иона), образуя так называемый адсорбционный слой (рис.59), а другая часть катионов под влиянием сил молекулярного движения распределяется на некотором расстоянии от поверхности металла, образуя диффузионный слой. Следовательно, изменение потенциала 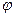 в двойном электрическом слое слагается из падения потенциала в адсорбционном и диффузионном слое.
в двойном электрическом слое слагается из падения потенциала в адсорбционном и диффузионном слое.
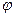 =
= 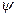 +
+ 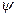 /
/
По мере увеличения концентрации катионов металла в растворе становится вероятным обратный процесс - восстановления ионов металла.
С течением времени скорость окисления металла становится равной скорости восстановления его ионов из раствора. На границе металл - раствор устанавливается равновесная разность потенциалов, которая называется равновесным электродным потенциалом (равновесный скачок потенциала).
Такая картина наблюдается для активных металлов. Это свидетельствует о том, что способность посылать ионы в раствор различных металлов выражена неодинаково. Она зависит от энергии ионизации атомов металла, от энергии гидратации ионов металла. Чем меньше энергия ионизации и больше энергия гидратации, тем выше способность металла окисляться и посылать свои ионы в раствор, при этом металл будет иметь и более отрицательный потенциал.
II. Малоактивные металлы (Cu, Ag) окисляются с трудом, выход ионов в раствор почти не происходит. Поэтому, например, в случае медного электрода, погруженного в раствор соли меди, преобладает адсорбция ионов металла на поверхности электрода. Схематично процесс можно изобразить следующим образом: [nCu] + x Cu2+ ∙ (H2O)m  [nCu]ּ xּ Cu2+ + mH2O
[nCu]ּ xּ Cu2+ + mH2O
В этом случае поверхность металла заряжается положительно, а прилегающий к ней раствор - отрицательно за счёт избытка в нём анионов (рис.60).
 |
а б
Рис. 60. Двойной электрический слой (а) и падение потенциала
в нём (б): l1 - адсорбционный слой; l2 - диффузионный слой.
III. Иной механизм возникновения потенциала на инертном электроде, который опущен в раствор, содержащий окисленную или восстановленную форму какого - либо соединения. Например, если в раствор FeCl3 опустить платиновый (инертный) электрод, то катион Fe3+ отнимает от поверхности платины электрон и превращается в ион Fe2+:
FeCl3 + ē → FeCl2 + Cl-
В результате платина получает положительный заряд, а раствор у поверхности её - отрицательный заряд за счёт образовавшегося избытка ионов Cl-. Равновесие в двойном электрическом слое выразится уравнением Fe3+ + e  Fe2+. Таким образом, возникает положительный потенциал на платине, который будет тем выше, чем больше окислительная способность катиона. И, наоборот, чем сильнее восстановительная активность иона, тем вероятней отдача электрона им в кристаллическую решётку платины и возникновение отрицательного заряда на ней. Так появляется отрицательный потенциал на платине в растворе, содержащем ионы Cr2+. В двойном слое устанавливается равновесие Cr2+
Fe2+. Таким образом, возникает положительный потенциал на платине, который будет тем выше, чем больше окислительная способность катиона. И, наоборот, чем сильнее восстановительная активность иона, тем вероятней отдача электрона им в кристаллическую решётку платины и возникновение отрицательного заряда на ней. Так появляется отрицательный потенциал на платине в растворе, содержащем ионы Cr2+. В двойном слое устанавливается равновесие Cr2+ 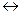 Cr3+ + e. Потенциал платины в разобранных двух примерах определяется соотношением активных концентраций окисленной и восстановленной формы ионов и характеризует окислительно-восстановительную способность каждой из систем Fe2+ , Fe3+ / Pt и Cr2+ ,Cr3+ / Pt, потому этот потенциал называется окислительно - восстановительным.
Cr3+ + e. Потенциал платины в разобранных двух примерах определяется соотношением активных концентраций окисленной и восстановленной формы ионов и характеризует окислительно-восстановительную способность каждой из систем Fe2+ , Fe3+ / Pt и Cr2+ ,Cr3+ / Pt, потому этот потенциал называется окислительно - восстановительным.
Во всех случаях возникающему электродному потенциалу присваивают тот знак, который имеет поверхность металла в двойном электрическом слое.
Разные металлы имеют различные потенциалы. Чем более активным является металл, тем отрицательнее его равновесный потенциал.
Потенциал электрода в растворе зависит не только от природы металла, но и от концентрации раствора и температуры. Зависимость равновесного потенциала электрода от концентрации выражается уравнением Нернста:
E 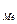 = E
= E 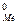 +
+ 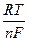 ln [Men+],
ln [Men+],
где [Men+]-концентрация ионов металла в растворе, г - моль/л;
R - универсальная газовая постоянная; 8,314 Дж/град. моль
n - валентность металла;
F - число Фарадея; 96 494 Кл/г-экв.
Т - температура раствора.
Подставив значение R и F при T = 2980, получим уравнение в приведенном виде:
EMe = E 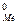 +
+ 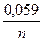 lg [Men+],
lg [Men+],
где E 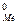 - стандартное значение электродного потенциала.
- стандартное значение электродного потенциала.
Потенциал называется стандартным (нормальным) в том случае, когда активность каждого из участников обратимой электродной реакции равна единице. Если окислитель или восстановитель в системе находится в газообразном состоянии (O2, Cl2, H2 и др.), то а = 1 при давлении газа 1 атм.
Так как до сих пор не существует методов измерения абсолютных величин потенциалов, то в качестве потенциала сравнения, условно принятого за нуль, выбран потенциал нормального водородного электрода (концентрация ионов [H+] в растворе H2SO4 равна 1 г – ион/л и p = 1 атм). По отношению к этому стандартному электроду измеряют потенциалы различных электродов. Значения стандартных электродных потенциалов сведены в таблицу. Ряд стандартных электродных потенциалов называют также рядом напряжений металлов. Каждый металл, стоящий в ряду напряжений левее, более активен,
чем следующий за ним, может вытеснять из растворов солей все металлы, которые следуют за ним; могут вытеснять водород из кислот, если стоят левее водорода.
Дата добавления: 2016-12-09; просмотров: 2438;











