Методы составления уравнения окислительно-восстановительных реакций
Для составления химических уравнений окислительно-восстановительных реакций применяют два метода:
а) электронного и б) ионно-электронного баланса.
Метод электронного баланса.Этот метод построен на подсчете общего числа электронов, переходящих от восстановителя к окислителю и определяется изменением окислительного числа элементов в реагирующих веществах до и после реакции.
В качестве примера рассмотрим реакцию:
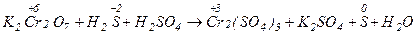
В ходе взаимодействия окислительные числа изменяют хром и сера, при этом О.Ч. хрома уменьшается (следовательно Cr+6 - окислитель), а серы увеличивается (S-2 - восстановитель). Значения стандартных окислительно-восстановительных потенциалов подтверждают правильное определение окислителя и восстановителя ( 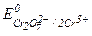 =1,033 В,
=1,033 В, 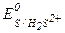 =1,14 В).
=1,14 В).
Составляются электронные схемы частных процессов окисления и восстановления:
2Сr+6 + 6  = 2Сr3+
= 2Сr3+
S -2 - 2  = S0
= S0
Молекула K2Cr2O7 содержит два атома хрома, поэтому в электронной схеме берут 2Cr+6. Затем определяются коэффициенты перед окислителем и восстановителем, исходя из правила: общее число отданных восстановителем электронов равно числу принятых окислителем. В приведенном случае такими коэффициентами являются числа: 3 - перед восстановителем и 1 - перед окислителем.
 2Cr+6 + 6
2Cr+6 + 6  =2Cr3+ 1
=2Cr3+ 1
S -2 - 2  =S0 3
=S0 3

2Cr+6 + S-2 = 2Cr3++S0
Найденные коэффициенты подставляют в левую часть уравнения рассматриваемой реакции. Коэффициенты для остальных соединений находятся путем сопоставления атомов в соединениях в левой и правой частях схемы. В результате окончательное уравнение реакции будет иметь вид:
K2Cr2O7 + 3H2S +4H2 SO4 = Cr2(SO4)3 + K2SO4 + 3S + 7H2O
Ионно-электронный метод.Ионно-электронный метод, так же как и метод электронного баланса, основан на определении общего количества элементов, перемещающихся от восстановителя к окислителю, но в этом методе коэффициенты определяют с учетом реальной формы ионов, участвующих во взаимодействии, и с учетом кислотности среды. Рассмотрим реакцию:
K2Cr2O7 + H2S + H2PO4 → Cr2(SO4)3 + S + K2SO4 + H2O
Или в ионной форме:
2К+ + Cr2O72- + H2S + 2Н+ + SO42- = 2Cr3+ + 3SO42- + S + 2К+ + SO42- + Н2O
При написании реакций в ионной форме следует помнить, что малодиссоциирующие, газообразные и труднорастворимые соединения записываются в уравнении в молекулярной форме.
Составляем ионно-электронные схемы для частных процессов окисления и восстановления с указанием исходных и образующихся реально существующих в условиях данной реакции ионов или молекул. Следует иметь ввиду, что в водных растворах большую роль играет среда, потому в реакциях могут участвовать молекулы Н2O, ионы Н+ или ОН-. Так, если продукт реакции содержит меньше кислорода (или вообще не содержит), чем исходный, то избыток кислорода связывается с молекулами воды с образованием гидроксид-ионов (О2- + Н2O = 2OН-).
Если продукт реакции содержит больше кислорода, чем исходное вещество, то недостающее количество кислорода в кислых и нейтральных средах берется из молекул воды, при этом освобождаются ионы водорода (Н2O = О2- + 2Н+), источником кислорода в щелочной среде служат ионы ОH-, при этом в качестве продукта реакции образуется вода (2OН- = О2- + Н2O).
Для рассматриваемого случая схемы полуреакций имеют вид:
Cr2O72- + 14Н+ → 2Сr3+ + 7Н2O
H2S → S + 2Н+
Левая часть первой схемы имеет суммарный заряд ионов +12 (-2 + 14 = 12), суммарный заряд правой части +6. Следовательно, в результате восстановления присоединяется 6 электронов;
во второй схеме левая часть содержит только незаряженные частицы (H2S), а суммарный заряд правой части равен +2. Следовательно, в результате окисления освобождаются два электрона, т.е.
 Cr2O72- + 14Н+ + 6
Cr2O72- + 14Н+ + 6  = 2Cr3+ + 7Н2O 1
= 2Cr3+ + 7Н2O 1
H2S - 2  = S + 2Н+ 3
= S + 2Н+ 3
Основные коэффициенты (1 и 3) подбираются также как и в методе электронного баланса.
Для составления ионного уравнения окислительно-восстановительной реакции следует просуммировать полученные полуреакции для процессов окисления и восстановления с учетом установленных коэффициентов при окислителе и восстановителе:
Cr2O72- + 14Н+ + 3H2S = 2Cr3+ + S + 7Н2O + 6Н+
Сократив на Н+, получим ионное уравнение с необходимыми стехиометрическими коэффициентами:
Cr2O72- + 8Н+ + 3H2S = 2Cr3+ + 3S+ 7Н2O
Для перехода к молекулярному уравнению следует поступать так: в левой части уравнения к каждому числу анионов приписывают соответствующее число катионов, а к катиону - анионов. Затем такие же ионы и в том же количестве записывают в правой части уравнения, после чего ионы объединяют в молекулы:
 Cr2O72- + 8Н+ + 3H2S = 2Cr3+ + 3S+ 7Н2O
Cr2O72- + 8Н+ + 3H2S = 2Cr3+ + 3S+ 7Н2O
2К+, 4SO42- 4SO42-, 2К+

К2Сr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 3S + K2SO4 + 7H2O
Особые случаи составления уравнений окислительно-восстановительных реакций.Чтобы без затруднений составлять уравнения окислительно-восстановительных реакций, следует иметь в виду некоторые общие случаи:
1. Если суммарное число электронов, отданное восстановителем (принятых окислителем), нечетно, а в результате реакции получается четное число атомов (хотя бы одного из элементов), то коэффициенты удваиваются. Например, в реакции


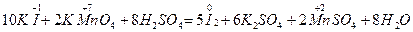 MnMnO4- + 8Н+ + 5
MnMnO4- + 8Н+ + 5  = Mn2+ + 4Н2O 1 2
= Mn2+ + 4Н2O 1 2
 I - 1
I - 1  =I0 5 10
=I0 5 10
2МnO4- + 16Н+ + 10I- = 2Мn2+ + 8Н2O +10I0
В этой реакции окислителем является ион МnO-4 ( 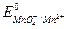 =1,54В), а восстановителем - ион I- (
=1,54В), а восстановителем - ион I- ( 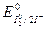 = 0,54В).
= 0,54В).
2. В ряде случаев окислитель (восстановитель) расходуется дополнительно на связывание образующихся в результате реакции ионов, как, например, в реакции:
КМnO4 + НСl → Сl2 + МnCl2 + Н2О + КСl

 МnO4- + 8Н+ + 5
МnO4- + 8Н+ + 5  = Mn2+ + 4Н2O 1 2
= Mn2+ + 4Н2O 1 2
 Сl--
Сl--  = С10 5 10
= С10 5 10
2МnO4- + 16Н+ + 10Cl- = 2Мn2+ + 8Н2O +5Сl2
2К+, 6Cl- 2К+, 6Сl-
В этой реакции 10 молекул НCl реагируют как восстановитель ( 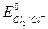 = 1,35 В) и еще 6 расходуются на связывание получающихся катионов калия и марганца (образование солей). В процессе восстановления иона-окислителя МnO4- участвует 5
= 1,35 В) и еще 6 расходуются на связывание получающихся катионов калия и марганца (образование солей). В процессе восстановления иона-окислителя МnO4- участвует 5  .
.
Получаем суммарное молекулярное уравнение:
2КМnO4 + 10НCl + 6НСl = 5Сl2 + 2МnCl2 + 8Н2O + КСl
или
2KMnO4 + 16НСl = 5С12 + 2МnCl2 + 8Н2O + 2КСl
Дата добавления: 2016-12-09; просмотров: 3927;











