Физические типы кристаллов.
Твердыми телами называются тела, которые обладают постоянством формы и объема. Различают кристаллические и аморфные твердые тела. Подавляющее большинство твердых тел в природе имеет кристаллическое строение (например, почти все минералы, металлы).
Рассмотрим отличительные особенности кристаллического состояния.
1. Самой характерной чертой кристаллических веществ является свойство анизотропии. Она заключается в зависимости ряда физических свойств (например, механических, тепловых, электрических, оптических) от направления.
Тела, свойства которых одинаковы по всем направлениям, называются изотропными. Газы, почти все жидкости и аморфные тела изотропны. Аморфные тела ведут себя как жидкости, но только потерявшие свойство текучести, или обладающие чрезвычайно высокой вязкостью. Некоторые вещества могут находиться и в кристаллическом, и в аморфном состоянии. Например, сера, которая в кристаллическом состоянии имеет минимальную энергию, поэтому кристаллическое состояние у серы устойчиво, а аморфное – нет.
Существует большая группа веществ, которые аморфными не являются, но обладают свойством изотропии. Это поликристаллические вещества. К ним относятся все металлы. Поликристалл состоит из плотно расположенных кристалликов. Изотропия объясняется беспорядком в расположении этих кристалликов.
Большие одиночные кристаллы, которые получают из расплава или раствора, называются монокристаллами.
2. Второй характерный признак, отличающий кристаллы от аморфных тел, – это поведение при расплавлении. Пусть тело равномерно нагревается и количество подводимого тепла постоянно. Тогда графически поведение  будет выглядеть следующим образом (9.15).
будет выглядеть следующим образом (9.15).
3. Кристаллические тела имеют правильную геометрическую форму. А аморфные нет. Если же форма кристалла нарушена условиями роста и механической обработки, то принадлежность образца к кристаллам может быть определена по следующим особенностям: 1) поверхность скола есть плоскость; 2) постоянство углов между плоскостями скола.
Кристаллическое состояние – это предмет изучения современной физики. В основе теории твердого тела лежит модель бесконечного совершенного монокристалла. Закономерное расположение частиц в кристалле соблюдается на сотнях тысяч или миллионах межчастичных расстояний. Поэтому говорят о существовании в кристаллах «дальнего порядка» расположения частиц в отличие от ближнего порядка в жидкостях и аморфных телах.
Вследствие правильного расположения атомов кристалл обладает свойствами симметрии. Симметрия кристаллической решетки – ее свойство совмещаться с собой при некоторых пространственных перемещениях, например параллельных переносах, поворотах, отражениях или их комбинациях и т. д. Например, правильный шестиугольник. Применительно к кристаллам имеются операции симметрии: поворот вокруг оси; зеркальное отображение в плоскости; зеркальное отображение в точке; зеркальное отражение в плоскости с последующим поворотом вокруг оси.
Идеальный монокристалл можно представить себе как периодическую структуру, называемую кристаллической решеткой. С геометрической точки зрения такую структуру можно получить с помощью операции параллельного переноса, которая называется трансляцией. Она описывается вектором:
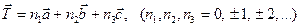
При перемещении кристалла вдоль трех направлений на отрезки a, b, c параллельно самому себе, будет воспроизводиться конфигурация частиц, образующих кристалл. Всякая пространственная решетка может быть составлена повторением в трех различных направлениях одного и того же структурного элемента –элементарной ячейки.
Для описания элементарных ячеек пользуются кристаллографическими осями координат, которые проводят параллельно ребрам элементарной ячейки, а начало координат выбирают в левом углу передней грани элементарной ячейки. Элементарная кристаллическая ячейка представляет собой параллелепипед, построенный на ребрах а, b, с с углами a, b и g между ребрами. Величины а, b, с и a, b и g называютсяпараметрами элементарной ячейки.
В зависимости от рода частиц, расположенных в узлах кристаллической решетки, и характера сил взаимодействия (притяжения) между ними кристаллы разделяются на четыре типа: ионные, атомные, молекулярные, металлические. Силы отталкивания обусловлены деформациями электронных оболочек ионов, атомов, молекул, то есть имеют единую природу для всех типов кристаллов.
1. Ионными называют кристаллы, в узлах которых находятся ионы чередующихся знаков. Силы притяжения обусловлены электростатическим притяжением зарядов. Связь, обусловленная кулоновскими силами притяжения между разноименными заряженными ионами называется ионной (или гетерополярной). В ионной решетке нельзя выделить отдельные молекулы: кристалл представляет собой как бы одну гигантскую молекулу. Примерами ионных кристаллов являются такие соединения как NaCl, CsCl, MgO, CaO .
2. Атомными называют такие кристаллы, в узлах кристаллической решетки которых расположены атомы. Силы притяжения обусловлены существующими между атомами ковалентными связями (или гомеополярными). Эти связи имеют квантово-механическое происхождение (когда два электрона принадлежат двум атомам и они неразличимы). Примеры ковалентных кристаллов – алмаз и графит (два различных состояния углерода), кремний, германий, некоторые неорганические соединения (ZnS, BeO и др.)
3. Молекулярные кристаллы – в узлах кристаллической решетки расположены нейтральные молекулы. Силы притяжения в них обусловлены силами Ван-дер-Ваальса, то есть незначительным смещением электронов в электронных оболочках атомов. Примеры молекулярных кристаллов – кристаллы инертных газов (Ne, Ar, Kr, Xe), лед, сухой лед СО2, а также газы О2, N2 в твердом состоянии. Ван-дер-ваальсовы силы довольно слабые, поэтому молекулярные кристаллы легко деформируются и разрушаются.
4. Решетки металлов – в узлах кристаллической решетки расположены положительные ионы металла, то есть элементы, потерявшие 2 или 3 электрона. Эти электроны находятся в движении и образуют своего рода идеальный газ электронов, которые удерживаются в электростатическом поле, создаваемом решеткой положительно заряженных ионов металлов. Это т.н. электроны проводимости. Они обусловливают электропроводность металлов. Кроме того, по структуре металлы являются поликристаллическими, этим объясняется шероховатая поверхность скола.
Кроме вышеуказанных типов связей между частицами в кристаллах возможны смешанные связи. Различные комбинации взаимодействий создают многообразие в строении кристаллов.
В различных плоскостях, которые можно провести в кристалле, расстояния между частицами окажутся различными. Так как силы, действующие между частицами, зависят от расстояния, то разнообразные физические свойства кристаллов зависят от направления, то есть кристалл является анизотропным.
Дата добавления: 2016-12-09; просмотров: 3474;











